इलेक्ट्रोलाइसिस | सामान्य जागरूकता/सामान्य जागरूकता - Police SI Exams PDF Download
परिचय
इलेक्ट्रोलिसिस एक इलेक्ट्रोलिटिक सेल में किया जाता है, जहाँ एक बाहरी वोल्टेज स्रोत एक रासायनिक प्रतिक्रिया को प्रेरित करता है। एक साधारण इलेक्ट्रोलिटिक सेल में दो तांबे की पट्टियाँ होती हैं, जो जलयुक्त तांबे के सल्फेट समाधान में डूबी होती हैं। जब DC वोल्टेज इलेक्ट्रोड्स पर लगाया जाता है, तो कैथोड पर तांबा धातु जमा होता है, और एनोड पर तांबा घुलता है।
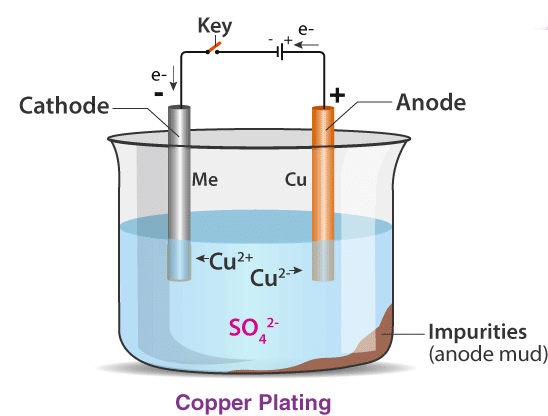
इलेक्ट्रोलिसिस के अनुप्रयोग:
- धातुओं की शुद्धिकरण: उदाहरण के लिए, अशुद्ध तांबे को इलेक्ट्रोलिटिक शुद्धिकरण के माध्यम से उच्च-शुद्धता तांबे में परिष्कृत किया जाता है।
- धातुओं का निष्कर्षण: सोडियम और मैग्नीशियम जैसे धातुओं को उनकी फ्यूज्ड क्लोराइड्स को इलेक्ट्रोलाइज करके प्राप्त किया जाता है, और एल्यूमिनियम को क्रायोलाइट के साथ गरम एल्यूमिनियम ऑक्साइड को इलेक्ट्रोलाइज करके तैयार किया जाता है।
- जैविक यौगिकों की तैयारी: इलेक्ट्रोलिसिस जैविक यौगिकों के संश्लेषण में सहायता करता है।
- टाइपोग्राफिक उद्योग: इलेक्ट्रोलिसिस को प्रिंटिंग के लिए ब्लॉक्स तैयार करने के लिए उपयोग किया जाता है।
- गैल्वनाइजेशन: गैल्वनाइजेशन के दौरान स्टील पर जिंक की कोटिंग की जाती है।
- इलेक्ट्रोकैमिकल श्रृंखला: धातुओं को उनके मानक अपघटन इलेक्ट्रोड पोटेंशियल के बढ़ते क्रम में व्यवस्थित किया जाता है ताकि इलेक्ट्रोकैमिकल श्रृंखला बन सके: K < ca="" />< na="" />< mg="" />< al="" />< zn="" />< cr="" />< fe="" />< ni="" />< h="" />< cu="" />< hg="" />< ag="" />< pd="" />< pt="" />< />
- इलेक्ट्रोकैमिकल सेल: एक इलेक्ट्रोकैमिकल सेल रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित करता है, जो एक स्वाभाविक रेडॉक्स प्रतिक्रिया के माध्यम से होता है। बैटरी, जो रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित करती हैं, विभिन्न उपकरणों और यंत्रों में व्यापक रूप से उपयोग की जाती हैं। एक बैटरी को हल्का, कॉम्पैक्ट और उपयोग के दौरान लगातार वोल्टेज बनाए रखना चाहिए। बैटरियों के दो मुख्य प्रकार होते हैं: प्राथमिक और द्वितीयक।
बैटरी
बैटरियाँ
- बैटरियाँ संग्रहीत रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित करती हैं।
- इन्हें विभिन्न उपकरणों और साधनों में सामान्यतः उपयोग किया जाता है।
- एक अच्छी बैटरी को हल्का और कॉम्पैक्ट होना चाहिए।
- इसका वोल्टेज उपयोग के दौरान स्थिर रहना चाहिए।
- बैटरियों की दो मुख्य श्रेणियाँ होती हैं: प्राथमिक और द्वितीयक।
प्राथमिक बैटरियाँ
प्राथमिक बैटरियों में, प्रतिक्रिया केवल एक बार होती है, और बैटरी अंततः समाप्त हो जाती है।
- ड्राई सेल (Leclanche Cell): इसमें एक जस्ता कंटेनर (एनोड) और कार्बन रॉड होती है जो मैंगनीज डाइऑक्साइड और कार्बन से घिरी होती है (कैथोड)। इलेक्ट्रोलाइट अमोनियम क्लोराइड और जस्ता क्लोराइड का एक नम पेस्ट होता है। सामान्यतः ट्रांजिस्टर और घड़ियों में उपयोग किया जाता है।
- मरकरी सेल: इसका उपयोग कम करंट वाले उपकरणों जैसे श्रवण यंत्र और घड़ियों में किया जाता है। इसमें जस्ता-मरकरी अमलगम एनोड और मरकरी ऑक्साइड तथा कार्बन पेस्ट से बना कैथोड होता है। इलेक्ट्रोलाइट पोटेशियम हाइड्रॉक्साइड और जस्ता ऑक्साइड का पेस्ट होता है।
द्वितीयक बैटरियाँ
द्वितीयक बैटरियों को उनके विपरीत दिशा में करंट प्रवाहित करके पुनः चार्ज किया जा सकता है।
- लीड स्टोरेज बैटरी: इसमें एक लीड एनोड और लीड डाइऑक्साइड से भरी ग्रिड होती है जो कैथोड के रूप में कार्य करती है, और इलेक्ट्रोलाइट के रूप में 38% सल्फ्यूरिक एसिड का घोल होता है। चार्ज करने पर लीड सल्फेट को फिर से लीड और लीड डाइऑक्साइड में परिवर्तित किया जाता है।
- निकेल कैडमियम सेल: इसकी उम्र लीड स्टोरेज सेल से अधिक होती है, इसमें एक कैडमियम एनोड और निकेल डाइऑक्साइड कैथोड होता है, और इलेक्ट्रोलाइट के रूप में पोटेशियम हाइड्रॉक्साइड का घोल होता है।
ईंधन सेल
ईंधन सेल सीधे ईंधन दहन (जैसे, हाइड्रोजन, कार्बन मोनोऑक्साइड, मीथेन) से ऊर्जा को विद्युत ऊर्जा में परिवर्तित करते हैं। एक हाइड्रोजन-ऑक्सीजन ईंधन सेल, जिसका उपयोग अपोलो अंतरिक्ष कार्यक्रम में किया गया था, H2 और O2 को कागज़ के कार्बन इलेक्ट्रोड के माध्यम से एक संकेंद्रित जल मिश्रण सोडियम हाइड्रॉक्साइड समाधान में डालता है, जिसमें पैलेडियम या प्लेटिनम उत्प्रेरक इलेक्ट्रोड की दक्षता को बढ़ाते हैं। हाइड्रोजन-ऑक्सीजन ईंधन सेल प्रदूषण मुक्त होते हैं, केवल पानी को उपोत्पाद के रूप में उत्पन्न करते हैं, और 70-75% दक्षता के साथ कार्य करते हैं, निरंतर ऊर्जा प्रदान करते हैं।
सूक्ष्मजीवीय ईंधन सेल (MFCs)
MFCs जैव-इलेक्ट्रोकैमिकल उपकरण होते हैं जो पानी की सफाई में ऊर्जा को प्राप्त करने के लिए अणायोगन पाचन का उपयोग करते हैं, अपशिष्ट जल से जैव ऊर्जा एकत्र करते हैं।
जंग
कई धातुएं, जैसे कि लोहे, हवा और पानी द्वारा आसानी से जंग खा जाती हैं। जंग, एक भूरे रंग का चटकदार पदार्थ, नम हवा के संपर्क में आने पर लोहा पर बनता है, जो मुख्यतः हाइड्रेटेड लोहे (III) ऑक्साइड (Fe2O3·xH2O) से बना होता है। जंग के अन्य उदाहरणों में चांदी का काला होना और तांबे या पीतल पर हरे आवरण का निर्माण शामिल हैं। जंग धातु के ऑक्सीकरण की प्रक्रिया है, जिसमें धातु ऑक्सीजन को इलेक्ट्रॉनों को खोकर ऑक्सीकरण करती है। लोहे के जंग को रोकने के लिए रंगाई, तेल लगाना, ग्रीस लगाना, गैल्वनाइजिंग (जस्ता कोटिंग) या क्रोम प्लेटिंग का उपयोग किया जा सकता है।
उत्प्रेरण
एक उत्प्रेरक किसी प्रतिक्रिया की दर को बिना स्वयं के उपभोग के बदलता है, जो द्रव्यमान और संरचना में अपरिवर्तित रहता है। उत्प्रेरण उस घटना को संदर्भित करता है जहां एक उत्प्रेरक प्रतिक्रिया दर को प्रभावित करता है। ठोस उत्प्रेरक आमतौर पर बारीक विभाजित होने पर अधिक प्रभावी होते हैं। उत्प्रेरक प्रतिक्रियाओं को प्रारंभ नहीं करते हैं या उल्टे प्रतिक्रियाओं की संतुलन स्थिति को नहीं बदलते; वे केवल प्रक्रिया को गति देते हैं और सक्रियण ऊर्जा को कम करते हैं।
औद्योगिक प्रक्रियाओं में अनुप्रयोग:
- हैबर प्रक्रिया: अमोनिया संश्लेषण के लिए आयरन का उत्प्रेरक और मोलिब्डेनम का प्रमोटर।
- संपर्क प्रक्रिया: सल्फ्यूरिक एसिड उत्पादन के लिए वैनाडियम पेंटॉक्साइड।
- ओस्टवाल्ड प्रक्रिया: नाइट्रिक एसिड उत्पादन के लिए प्लैटिनम गॉज।
- डीकन प्रक्रिया: क्लोरीन उत्पादन के लिए क्यूप्रिक क्लोराइड।
- पेट्रोल का संश्लेषण: उत्प्रेरकों के रूप में निकल, आयरन, कोबाल्ट, और एल्युमिना।
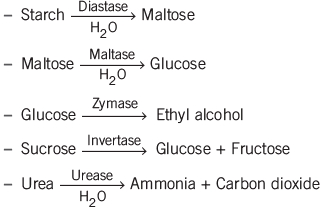
एंजाइम उत्प्रेरण
एंजाइम उत्प्रेरण में एंजाइम प्रतिक्रियाओं की दर को बढ़ाते हैं। एंजाइम, जो प्रोटीन होते हैं, अत्यधिक विशिष्ट और तापमान के प्रति संवेदनशील होते हैं, जिनका इष्टतम तापमान 25-37°C के बीच होता है। एंजाइमेटिक प्रतिक्रियाओं की दर पर pH परिवर्तनों का महत्वपूर्ण प्रभाव पड़ता है।
|
450 docs|394 tests
|
















