सत् और इसकी प्रकृति | General Awareness & Knowledge for RRB NTPC (Hindi) - RRB NTPC/ASM/CA/TA PDF Download
परिचय
पदार्थ वह मौलिक पदार्थ है जो ब्रह्मांड का निर्माण करता है। जो कुछ भी हम देखते हैं, छूते हैं और अनुभव करते हैं, वह पदार्थ से बना होता है। पदार्थ की प्रकृति को समझना उन छात्रों के लिए महत्वपूर्ण है जो IIT-JEE जैसे प्रतियोगी परीक्षाओं की तैयारी कर रहे हैं, क्योंकि यह रसायन विज्ञान और भौतिकी के कई सिद्धांतों का आधार बनता है। इस लेख का उद्देश्य पदार्थ और इसकी प्रकृति का एक व्यापक और विस्तृत व्याख्या करना है, जिसे छात्रों के अनुकूल तरीके से प्रस्तुत किया गया है।
पदार्थ की परिभाषा और वर्गीकरण
पदार्थ क्या है?

पदार्थ को परिभाषित किया जाता है कि यह कुछ भी है जिसका द्रव्यमान होता है और यह स्थान घेरता है। यह कणों जैसे कि परमाणु और अणु से बना होता है, जो सभी भौतिक पदार्थों के निर्माण ब्लॉक हैं। पदार्थ का अध्ययन इसके गुणों, व्यवहार और विभिन्न स्थितियों में अंतःक्रियाओं की खोज करना शामिल है।
पदार्थ के राज्य
पदार्थ तीन मुख्य राज्यों में मौजूद होता है: ठोस, तरल, और गैस। प्रत्येक राज्य में कणों के विन्यास और गति के आधार पर विशिष्ट विशेषताएँ होती हैं।
ठोस अवस्था:
- कण एक निश्चित, व्यवस्थित विन्यास में निकटता से पैक होते हैं।
- ठोसों का एक निश्चित आकार और मात्रा होती है।
- अणुओं के बीच बल मजबूत होते हैं, जिससे कणों की गति सीमित होती है।
- उदाहरण: बर्फ, लोहे, लकड़ी।
तरल अवस्था:
- कण निकटता से पैक होते हैं, लेकिन एक निश्चित विन्यास में नहीं होते।
- तरल की एक निश्चित मात्रा होती है लेकिन यह अपने कंटेनर का आकार ले लेता है।
- अणुओं के बीच बल ठोस की तुलना में कमजोर होते हैं, जिससे कण स्वतंत्र रूप से गति कर सकते हैं।
- उदाहरण: पानी, तेल, शराब।
गैसीय अवस्था:
- कण एक दूसरे से दूर होते हैं और स्वतंत्र रूप से चलते हैं।
- गैसों का कोई निश्चित आकार या मात्रा नहीं होती।
- गैसें अपने कंटेनर के आकार में फैल जाती हैं।
- उदाहरण: वायु, कार्बन डाइऑक्साइड।
कण एक दूसरे से बहुत दूर होते हैं और स्वतंत्र रूप से चलते हैं। गैसों का न तो कोई निश्चित आकार होता है और न ही मात्रा; वे अपने बर्तन को भरने के लिए फैलती हैं। अंतरकणीय बल बहुत कमजोर होते हैं, जिसके परिणामस्वरूप कणों का उच्च गति से चलना होता है। उदाहरण: ऑक्सीजन, नाइट्रोजन, कार्बन डाइऑक्साइड।
अन्य पदार्थों के अवस्थाएँ
प्राथमिक अवस्थाओं के अलावा, पदार्थ अन्य रूपों में भी अस्तित्व में रह सकता है जब वह अत्यधिक परिस्थितियों में होता है:
प्लाज़्मा:
- एक उच्च-ऊर्जा अवस्था जहाँ अणु आयनित होते हैं (इलेक्ट्रॉन नाभिक से अलग होते हैं)।
- सितारों, जिसमें सूर्य भी शामिल है, और कुछ प्रयोगशाला स्थितियों में सामान्य है।
- उदाहरण: बिजली, नीयॉन संकेत।
Bose-Einstein Condensate (BEC):
- एक पदार्थ की अवस्था जो लगभग पूर्ण शून्य तापमान पर बनती है।
- कण एक ही स्थान और क्वांटम अवस्था में होते हैं, एकल क्वांटम इकाई के रूप में कार्य करते हैं।
- उदाहरण: सुपरफ्लुइड हीलियम।
पदार्थ के गुण
पदार्थ में कई गुण होते हैं जिन्हें भौतिक और रासायनिक गुणों में वर्गीकृत किया जा सकता है।
भौतिक गुण
भौतिक गुण ऐसे लक्षण होते हैं जिन्हें पदार्थ की संरचना को बदले बिना देखा या मापा जा सकता है। इनमें शामिल हैं:
गुणन और मात्रा:
- गुणन किसी पदार्थ में मौजूद पदार्थ की मात्रा होती है, जिसे किलोग्राम या ग्राम में मापा जाता है।
- मात्रा उस स्थान की मात्रा होती है जो पदार्थ द्वारा घेर ली जाती है, जिसे लीटर या घन मीटर में मापा जाता है।
घनत्व:
- घनत्व किसी पदार्थ की प्रति इकाई मात्रा में गुणन होता है।
- सूत्र: घनत्व (ρ) = गुणन (m) / मात्रा (V)।
पिघलने और उबलने के बिंदु:
- पिघलने का बिंदु वह तापमान होता है जिस पर एक ठोस द्रव्य तरल में बदल जाता है।
- उबलने का बिंदु वह तापमान होता है जिस पर एक तरल द्रव्य गैस में बदल जाता है।
घुलनशीलता:
घुलनशीलता किसी पदार्थ के विलायक में घुलने की क्षमता है। यह तापमान और दाब के साथ बदलती है।
संवेदीता:
- Electrical conductivity किसी पदार्थ की बिजली संचारित करने की क्षमता है।
- Thermal conductivity गर्मी संचारित करने की क्षमता है।
रासायनिक गुण
रासायनिक गुण एक पदार्थ की रासायनिक परिवर्तनों को सहन करने और नए पदार्थों का निर्माण करने की क्षमता को बताते हैं। इनमें शामिल हैं:
प्रतिक्रिया:
- प्रतिक्रिया का अर्थ है कि एक पदार्थ कितनी आसानी से रासायनिक प्रतिक्रियाओं में भाग लेता है। उच्च प्रतिक्रियाशील पदार्थ, जैसे कि सोडियम, अन्य सामग्रियों के साथ जल्दी प्रतिक्रिया करते हैं।
दहन:
- दहन ऑक्सीजन की उपस्थिति में जलने की प्रक्रिया है, जो गर्मी और प्रकाश उत्पन्न करती है। उदाहरण: लकड़ी, गैसोलीन का जलना।
ऑक्सीडेशन:
- ऑक्सीडेशन एक पदार्थ के ऑक्सीजन के साथ प्रतिक्रिया करने की प्रक्रिया है। उदाहरण: लोहे का जंग लगना, चांदी का काला होना।
अम्लता और क्षारीयता:
- अम्लता एक पदार्थ के हाइड्रोजन आयनों (H+) को दान करने की प्रवृत्ति है।
- क्षारीयता हाइड्रॉक्साइड आयनों (OH-) को दान करने की प्रवृत्ति है। इसे pH स्केल का उपयोग करके मापा जाता है।
परमाणु सिद्धांत
ऐतिहासिक विकास
पदार्थ का सिद्धांत सदियों से विकसित हुआ है, जिसमें विभिन्न वैज्ञानिकों का महत्वपूर्ण योगदान रहा है:
डेमोक्रिटस (460-370 ईसा पूर्व):
- उन्होंने प्रस्तावित किया कि पदार्थ अविभाज्य कणों से बना है, जिन्हें “एटोमॉस” कहा जाता है।
जॉन डाल्टन (1766-1844):
- उन्होंने आधुनिक परमाणु सिद्धांत विकसित किया। उन्होंने कहा कि परमाणु पदार्थ की सबसे छोटी इकाइयाँ हैं और इन्हें न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है।
जे.जे. थॉमसन (1856-1940):
इलेक्ट्रॉन की खोज कैथोड रे प्रयोग के द्वारा की गई। "प्लम पुडिंग" मॉडल का प्रस्ताव रखा गया, जिसमें इलेक्ट्रॉन एक सकारात्मक चार्ज वाले गोले में समाहित होते हैं।
अर्नेस्ट रदरफोर्ड (1871-1937):
- सोने की पन्नी प्रयोग (गोल्ड फोइल एक्सपेरिमेंट) किया।
- परमाणु का न्यूक्लियर मॉडल प्रस्तुत किया, जिसमें एक घना, सकारात्मक चार्ज वाला न्यूक्लियस होता है और इसके चारों ओर इलेक्ट्रॉन होते हैं।
नील्स बोह्र (1885-1962):
- बोहर मॉडल पेश किया, जिसमें इलेक्ट्रॉन न्यूक्लियस के चारों ओर निश्चित ऊर्जा स्तरों में परिक्रमा करते हैं।
एर्विन श्रödिंगर (1887-1961) और वर्नर हाइजेनबर्ग (1901-1976):
- क्वांटम यांत्रिकी (क्वांटम मैकेनिक्स) का विकास किया।
- इलेक्ट्रॉन की संभाव्यता बादलों (प्रोबेबिलिटी क्लाउड) और अनिश्चितता सिद्धांत (अनसर्टेण्टी प्रिंसिपल) का परिचय दिया।
आधुनिक परमाणु सिद्धांत
आधुनिक परमाणु सिद्धांत कहता है कि:
- परमाणु पदार्थ की मूल इकाइयाँ हैं, जिनमें एक न्यूक्लियस (प्रोटॉन और न्यूट्रॉन) और इलेक्ट्रॉन होते हैं।
- इलेक्ट्रॉन न्यूक्लियस के चारों ओर ऑर्बिटल में रहते हैं, जो क्वांटम नंबर द्वारा परिभाषित होते हैं।
- समान तत्व के परमाणुओं में समान संख्या में प्रोटॉन होते हैं लेकिन उनमें न्यूट्रॉन की संख्या भिन्न हो सकती है (आइसोटोप)।
- रासायनिक प्रतिक्रियाएँ इलेक्ट्रॉन के पुनर्गठन से संबंधित होती हैं, न कि न्यूक्लियस में परिवर्तनों से।
तत्व, यौगिक, और मिश्रण
एक तत्व एक शुद्ध पदार्थ है, जिसमें केवल एक प्रकार के परमाणु होते हैं। तत्वों को रासायनिक तरीकों से सरल पदार्थों में नहीं तोड़ा जा सकता। इन्हें इनके गुणों के आधार पर वर्गीकृत किया जाता है:
धातु:
- अच्छे गर्मी और बिजली के चालक होते हैं।
- मैलिबल, डक्टाइल, और चमकदार दिखावट होती है।
- उदाहरण: सोना, चाँदी, तांबा।
गैर-धातु:
ताप और बिजली के लिए गरीब संचालक।
भंगुर और धात्विक चमक की कमी।
उदाहरण: ऑक्सीजन, सल्फर, कार्बन।
धातुमय तत्व:
- धातुओं और अधातुओं के बीच के गुण होते हैं।
- उदाहरण: सिलिकॉन, जर्मेनियम।
संयोग एक पदार्थ है जो तब बनता है जब दो या दो से अधिक तत्व एक निश्चित अनुपात में रासायनिक रूप से मिलते हैं। संयोगों के गुण उन तत्वों से भिन्न होते हैं जो इन्हें बनाते हैं। उदाहरणों में पानी (H2O), कार्बन डाइऑक्साइड (CO2), और सोडियम क्लोराइड (NaCl) शामिल हैं।
मिश्रण दो या अधिक पदार्थों का संयोजन है जो अपनी व्यक्तिगत गुणों को बनाए रखते हैं। मिश्रण समरूप या विषम हो सकते हैं:
समरूप मिश्रण:
- संपूर्ण में समान संरचना।
- इन्हें समाधान भी कहा जाता है।
- उदाहरण: नमकीन पानी, हवा।
विषम मिश्रण:
- गैर-समान संरचना।
- अलग-अलग घटक देखे जा सकते हैं।
- उदाहरण: रेत और लोहे की filings, तेल और पानी।
परमाण्विक और आणविक संरचना
परमाण्विक संरचना:
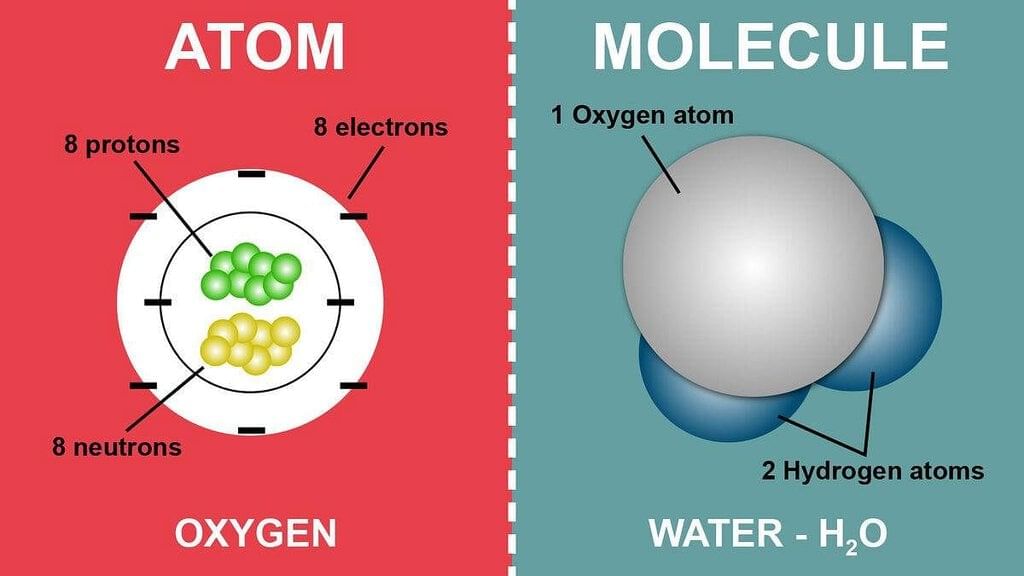
परमाणु एक नाभिक से मिलकर बना होता है जिसमें प्रोटॉन और न्यूट्रॉन होते हैं, जो विभिन्न ऊर्जा स्तरों या कक्षाओं में इलेक्ट्रॉनों द्वारा घेरित होता है।
नाभिक:
- प्रोटॉन (सकारात्मक चार्ज) और न्यूट्रॉन (निष्क्रिय) होते हैं।
- परमाणु के द्रव्यमान का अधिकांश हिस्सा यही होता है।
इलेक्ट्रॉन:
- नकारात्मक चार्ज वाले कण।
- नाभिक के चारों ओर कक्षाओं में व्यवस्थित होते हैं।
आणविक तब बनती है जब परमाणु आपस में बंधते हैं। इन बंधनों का प्रकार और व्यवस्था उस आणविक के गुणों को निर्धारित करती है।
कोवैलेंट बंध:
- परमाणुओं के बीच इलेक्ट्रॉनों के साझा करने से बनते हैं।
- उदाहरण: H2, O2, H2O।
आयनिक बंध:
इलेक्ट्रॉनिक बंधन:
- इलेक्ट्रॉनों के एक परमाणु से दूसरे परमाणु में स्थानांतरण द्वारा निर्मित, जिसके परिणामस्वरूप सकारात्मक और नकारात्मक चार्ज वाले आयन बनते हैं।
- उदाहरण: NaCl, MgO।
धात्विक बंधन:
- धातु परमाणुओं के बीच बने, जहां इलेक्ट्रॉन संरचना में स्वतंत्र रूप से चलते हैं।
- उदाहरण: तांबा (Copper), लोहे (Iron)।
अवधारणात्मक तालिका
अवधारणात्मक तालिका का विकास:
अवधारणात्मक तालिका तत्वों को उनके आणविक संख्या, इलेक्ट्रॉन विन्यास, और आवर्ती रासायनिक गुणों के आधार पर व्यवस्थित करती है। इसे वैज्ञानिकों के योगदान से विकसित किया गया था जैसे:
डिमित्री मेंडेलेव (1834-1907):
- पहली अवधारणात्मक तालिका बनाई, जिसमें तत्वों को उनके आणविक द्रव्यमान के अनुसार व्यवस्थित किया।
- अविष्कृत तत्वों के अस्तित्व की भविष्यवाणी की।
हेनरी मोस्ले (1887-1915):
- तत्वों को उनके आणविक संख्या के अनुसार व्यवस्थित किया, जिससे आधुनिक अवधारणात्मक तालिका बनी।
अवधारणात्मक तालिका की संरचना:
अवधारणात्मक तालिका को अवधियों (पंक्तियों) और समूहों (कॉलम) में विभाजित किया गया है:
अवधियाँ:
- क्षैतिज पंक्तियाँ जो 1 से 7 तक क्रमांकित हैं।
- एक ही अवधि में तत्वों में समान संख्या में इलेक्ट्रॉन शेल होते हैं।
समूह:
- ऊर्ध्वाधर कॉलम जो 1 से 18 तक क्रमांकित हैं।
- एक ही समूह में तत्वों में समान रासायनिक गुण होते हैं क्योंकि उनके पास समान संख्या में वैलेन्स इलेक्ट्रॉन होते हैं।
अवधारणात्मक प्रवृत्तियाँ:
अवधारणात्मक तालिका में तत्वों के विभिन्न गुणों में प्रवृत्तियाँ देखी जाती हैं:
आणविक त्रिज्या:
- एक अवधि में (बाएँ से दाएँ) बढ़ती है, जो बढ़ती नाभिकीय चार्ज के कारण घटती है।
- एक समूह में नीचे बढ़ती है क्योंकि इलेक्ट्रॉन शेल्स की संख्या बढ़ती है।
आयनन ऊर्जा:
आवेश:
- आवेश एक कालक्रम में बढ़ता है क्योंकि नाभिकीय चार्ज अधिक होता है।
- एक समूह में दूरी बढ़ने के कारण यह कम होता है।
इलेक्ट्रोनैगेटिविटी:
- इलेक्ट्रोनैगेटिविटी कालक्रम में बढ़ती है क्योंकि परमाणु अधिक मजबूती से इलेक्ट्रॉनों को आकर्षित करते हैं।
- एक समूह में यह कम होती है क्योंकि परमाणुओं का इलेक्ट्रॉनों पर कम खींचाव होता है।
धात्विक और अधात्विक विशेषताएँ:
- धात्विक विशेषता कालक्रम में कम होती है और एक समूह में बढ़ती है।
- अधात्विक विशेषता इसका विपरीत प्रवृत्ति दिखाती है।
रासायनिक प्रतिक्रियाएँ और समीकरण
रासायनिक प्रतिक्रियाओं के प्रकार

रासायनिक प्रतिक्रियाएँ परमाणुओं के पुनर्व्यवस्थापन में शामिल होती हैं, जिससे नए पदार्थ बनते हैं। प्रमुख प्रकार हैं:
संयोग प्रतिक्रियाएँ:
- दो या दो से अधिक पदार्थ मिलकर एक एकल उत्पाद बनाते हैं।
- A + B → AB.
विघटन प्रतिक्रियाएँ:
- एक एकल यौगिक दो या अधिक उत्पादों में टूटता है।
- AB → A + B.
स्थानांतरण प्रतिक्रियाएँ:
- एक तत्व किसी यौगिक में दूसरे तत्व को विस्थापित करता है।
- A + BC → AC + B.
द्विगुणित स्थानांतरण प्रतिक्रियाएँ:
- दो यौगिकों के बीच आयनों का आदान-प्रदान होता है।
- AB + CD → AD + CB.
दहन प्रतिक्रियाएँ:
- एक पदार्थ ऑक्सीजन के साथ प्रतिक्रिया करता है, जिससे गर्मी और प्रकाश उत्पन्न होता है।
- हाइड्रोकार्बन + O2 → CO2 + H2O.
रासायनिक समीकरणों का संतुलन
रासायनिक समीकरणों का संतुलन द्रव्यमान के संरक्षण को सुनिश्चित करता है। समीकरण के प्रत्येक पक्ष में प्रत्येक तत्व के परमाणुओं की संख्या समान होनी चाहिए। चरणों में शामिल हैं:
- असंतुलित समीकरण लिखें।
- दोनों पक्षों पर प्रत्येक तत्व के परमाणुओं की संख्या गिनें।
- परमाणुओं को संतुलित करने के लिए गुणांक का उपयोग करें।
- जांचें कि सभी परमाणु संतुलित हैं और यदि आवश्यक हो तो समायोजित करें।
स्टोइकियोमेट्री
स्टॉइकियोमेट्री संतुलित रासायनिक समीकरणों के आधार पर गणनाओं से संबंधित है। इसमें शामिल हैं:
मोल सिद्धांत:
- एक मोल किसी पदार्थ के 6.022 × 1023 कण होते हैं।
- मोलर द्रव्यमान किसी पदार्थ के एक मोल का द्रव्यमान होता है।
गणनाएँ:
- प्रतिक्रिया और उत्पादों के मोल अनुपात को निर्धारित करने के लिए संतुलित समीकरण का उपयोग करें।
- आवश्यकतानुसार मोल को ग्राम या लीटर में परिवर्तित करें।
निष्कर्ष:
पदार्थ के स्वभाव को समझना रसायन विज्ञान पर महारत हासिल करने के लिए आवश्यक है। यह व्यापक अवलोकन परिभाषा, वर्गीकरण, गुण, परमाणु सिद्धांत, आवर्त सारणी, और रासायनिक प्रतिक्रियाओं को कवर करता है, जो IIT-JEE जैसे प्रतिस्पर्धी परीक्षाओं की तैयारी कर रहे छात्रों के लिए एक मजबूत आधार प्रदान करता है। इन सिद्धांतों का अध्ययन करके, छात्र भौतिक दुनिया की जटिलता और सुंदरता के प्रति एक गहरा प्रशंसा विकसित कर सकते हैं।
|
464 docs|420 tests
|





















