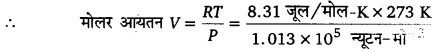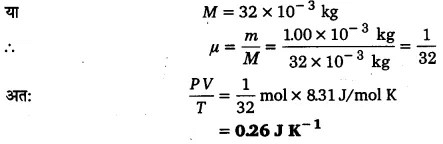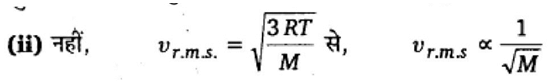अणुगति सिद्धांत (Kinetic Theory) NCERT Solutions | NCERT Textbooks in Hindi (Class 6 to Class 12) - CTET & State TET PDF Download
अभ्यास
प्रश्न.1. ऑक्सीजन के अणुओं के आयतन और STP पर इनके द्वारा घेरे गए कुल आयतन का अनुपात ज्ञात कीजिए। ऑक्सीजन के एक अणु का व्यास 3Å लीजिए।
आवोगाद्रो की परिकल्पना के अनुसार S T P पर गैस के 1 मोल द्वारा घेरा गया आयतन
V = 22.4 लीटर = 22.4 x 10-3 मी3
तथा 1 ग्राम मोल में अणुओं की संख्या = आवोगाद्रो संख्या
N = 6.02 x 1023
ऑक्सीजन के एक अणु की त्रिज्या
r = व्यास/2 = 3 Å/2= 1.5 x 10-10 मी
∴ ऑक्सीजन के एक अणु का आयतन
प्रश्न.2. मोलर आयतन, STP पर किसी गैस (आदर्श) के 1 मोल द्वारा घेरा गया आयतन है। (STP:1 atm दाब, 0°C ताप)। दर्शाइए कि यह 22.4 लीटर है।
S.T.P. का अर्थ P = 1 वायुमण्डलीय दाब = 1.013 x 105 न्यूटन-मीटर-2
तथा T = 0 + 273 = 273 K है तथा R = 8.31 जूल/मोल-K
∴ (1 मोल के लिए) आदर्श गैस समीकरण PV = RT से ।
= 22.395 x 10-3 मी-3 ≈ 22.4 लीटर
प्रश्न.3. चित्र-13.8 में ऑक्सीजन के 100 x 10-3kg द्रव्यमान के लिए PV/T एवं P में, दो अलग-अलग तापों पर ग्राफ दर्शाए गए हैं।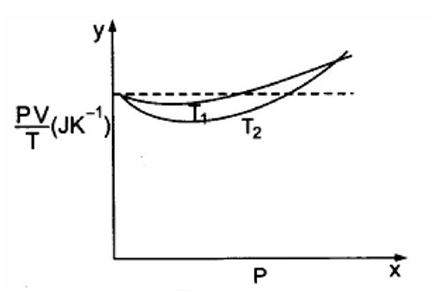 (a) बिन्दुकित रेखा क्या दर्शाती है?
(a) बिन्दुकित रेखा क्या दर्शाती है?
(b) क्या संत्य है : T1 > T2 अथवा T1 < T2?
(c) y-अक्ष पर जहाँ वक्र मिलते हैं वहाँ PV/T का मान क्या है?
(d) यदि हम ऐसे ही ग्राफ 100 x 10-3 kg हाइड्रोजन के लिए बनाएँ तो भी क्या उस बिन्दु पर जहाँ वक़ y-अक्ष से मिलते हैं PV/T का मान यही होगा? यदि नहीं, तो हाइड्रोजन के कितने द्रव्यमान के लिए PV/T का मान (कम दाब और उच्च ताप के क्षेत्र के लिए वही होगा? H2 का अणु द्रव्यमान = 2.02 u, O2 का अणु द्रव्यमान = 32.0 u, R = 8.31 J mol-1K-1)
(a) बिन्दुकित रेखा यह दर्शाती है, कि राशि PV/T नियत है। यह तथ्य केवल आदर्श गैस के लिए सत्य है; अतः बिन्दुकित रेखा आदर्श गैस का ग्राफ है।
(b) हम देख सकते हैं कि ताप T2 पर ग्राफ की तुलना में ताप T1 पर गैस का ग्राफ आदर्श गैस के ग्राफ के अधिक समीप है अर्थात् ताप T2 पर ऑक्सीजन गैस का आदर्श गैस के व्यवहार से विचलन अधिक है।
हम जानते हैं कि वास्तविक गैसें निम्न ताप पर आदर्श गैस के व्यवहार से अधिक विचलित होती है।
अतः T1 > T2
(c) जिस बिन्दु पर ग्राफ y-अक्ष पर मिलते हैं ठीक उसी बिन्दु से आदर्श गैस का ग्राफ भी गुजरता है;अतः इस बिन्दु पर ऑक्सीजन गैस, आदर्श गैस समीकरण का पालन करेगी।
अत: PV = µRT से, PV/T = µR
∵ गैस का द्रव्यमान m= 1.00 x 10-3 kg जबकि गैस का ग्राम अणुभार M = 32g
(d) इस बिन्दु पर गैस, आदर्श गैस समीकरण का पालन करेगी; अतः PV/T = µR होगा। परन्तु समान द्रव्यमान हाइड्रोजन गैस में ग्राम-अणुओं की संख्या भिन्न होगी; अत: हाइड्रोजन गैस के लिए PV/T का मान भिन्न होगा।
H2 गैस के लिए PV/T = µR का वही मान प्राप्त करने के लिए हमें ग्राम-अणुओं की संख्या वही
लेनी होगी।
प्रश्न.4. एक ऑक्सीजन सिलिण्डर जिसका आयतन 30 L है, में ऑक्सीजन का आरम्भिक दाब 15 atm एवं ताप 27°c है। इसमें से कुछ गैस निकाल लेने के बाद प्रमापी (गेज) दाब गिरकर 11 atm एवं ताप गिरकर 17°C हो जाता है। ज्ञात कीजिए कि सिलिण्डर से ऑक्सीजन की कितनी मात्रा निकाली गई है? (R = 8.31 J mol-1K-1, ऑक्सीजन का अणु द्रव्यमान O2 = 32u)।
μ ग्राम मोल के लिए आदर्श गैस समीकरण
PV = μ RT (जहाँ μ = m/M)
अतः PV= (m/M) RT
(जहाँ m= ग्राम में द्रव्यमान, M = ग्राम में अणुभार)
प्रश्न.5. वायु का एक बुलबुला, जिसका आयतन 1.0 cm3 है, 40 m गहरी झील की तली से जहाँ ताप 12°c है, उठकर ऊपर पृष्ठ पर आता है जहाँ ताप 35°c है। अब इसका आयतन क्या होगा?
दिया है : बुलबुले का आयतन V1 = 1.0 cm3 = 1.0 x 10-6m3
अन्तिम आयतन V2 = ?
प्रश्न.6. एक कमरे में, जिसकी धारिता 25.0 m3 है, 27°C ताप और 1 atm दाब पर, वायु के कुल अणुओं (जिनमें नाइट्रोजन, ऑक्सीजन, जलवाष्प और अन्य सभी अवयवों के कण सम्मिलित हैं) की संख्या ज्ञात कीजिए।
दिया है : कमरे की धारिता V = 25.0 m3, ताप T = 27 + 273 = 300K,
दाब P = 1 atm = 1.01 x 105 N m-2
कुल अणुओं की संख्या = ?
प्रश्न.7. हीलियम परमाणु की औसत तापीय ऊर्जा का आकलन कीजिए-
(i) कमरे के ताप (27°C) पर।
(ii) सूर्य के पृष्ठीय ताप (6000 K) पर।
(iii) 100 लाख केल्विन ताप (तारे के क्रोड का प्रारूपिक ताप) पर।
हीलियम एक परमाणु गैस है। अत: परमाणु की औसत तापीय ऊर्जा अणु की औसत तापीय ऊर्जा ही होगी। किसी गैस के एक अणु की औसत तापीय ऊर्जा (गतिज ऊर्जा)
(जहाँ T = परमताप,
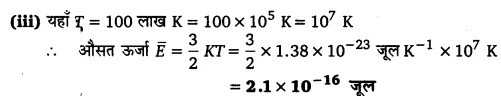
प्रश्न.8. समान धारिता के तीन बर्तनों में एक ही ताप और दाब पर गैसे भरी हैं। पहले बर्तन में निऑन (एकपरमाणुक) गैस है, दूसरे में क्लोरीन (द्विपरमाणुक) गैस है और तीसरे में यूरेनियम हेक्साफ्लोराइड (बहुपरमाणुक) गैस है। क्या तीनों बर्तनों में गैसों के संगत अणुओं की संख्या समान है? क्या तीनों प्रकरणों में अणुओं की υr.m.s (वर्ग-माध्य-मूल चाल) समान है?
(i) हाँ, चूँकि आवोगाद्रो परिकल्पना के अनुसार समान परिस्थितियों में गैसों के समान आयतन में अणुओं की संख्या समान होती है।
तीनों गैसों के ग्राम-अणु भार अलग-अलग हैं; अतः अणुओं की वर्ग-माध्य-मूल चाल भी अलग-अलग होगी।
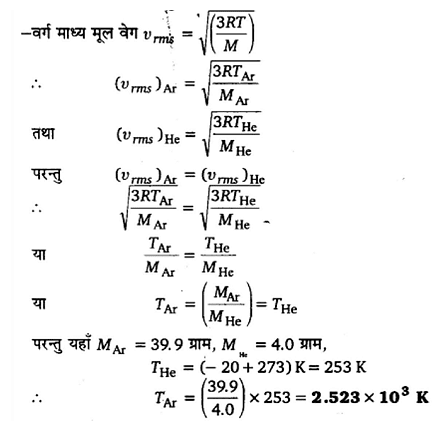
प्रश्न.9. किस ताप पर ऑर्गन गैस सिलिण्डर में अणुओं की υr.m.s, -20°C पर हीलियम गैस परमाणुओं की υr.m.s के बराबर होगी? (Ar का परमाणु द्रव्यमान = 39.9u एवं हीलियम का परमाणु द्रव्यमान = 4.0u)
प्रश्न.10. नाइट्रोजन गैस के एक सिलिण्डर में, 2.0 atm दाब एवं 17°C ताप पर, नाइट्रोजन अणुओं के माध्य मुक्त पथ एवं संघट्ट आवृत्ति का आकलन कीजिए। नाइट्रोजन अणु की त्रिज्या लगभग 1.0 Å लीजिए। संघट्ट-काल की तुलना अणुओं द्वारा दो संघट्टों के बीच स्वतन्त्रतापूर्वक चलने में लगे समय से कीजिए। (नाइट्रोजन का आणविक द्रव्यमान = 28.0u)।
P = 2.0, वायुमण्डलीय = 2 x 1.013 x 105 = 2.026 x 105 न्यूटन मीटर-2,
T = 17°C = 17 + 273 = 290 K1 मोल गैस के लिए, PV = RT
|
967 docs|393 tests
|