NCERT सारांश: भौतिकी- 1 का सारांश | UPSC CSE (हिंदी) के लिए पुरानी और नई एनसीईआरटी अवश्य पढ़ें PDF Download
परमाणु भौतिकी
एक परमाणु तत्व का सबसे छोटा कण है जो स्वतंत्र रूप से अस्तित्व में रह सकता है और अपनी सभी रासायनिक विशेषताओं को बनाए रख सकता है।
1. डाल्टन का परमाणु सिद्धांत: इसने सुझाव दिया कि परमाणु विभाज्य और नाशकारी नहीं है। लेकिन परमाणु के अंदर दो मौलिक कणों (इलेक्ट्रॉनों और प्रोटॉनों) की खोज ने डाल्टन के इस सिद्धांत के इस पहलू की असफलता का कारण बना।
2. थॉमसन का परमाणु सिद्धांत:
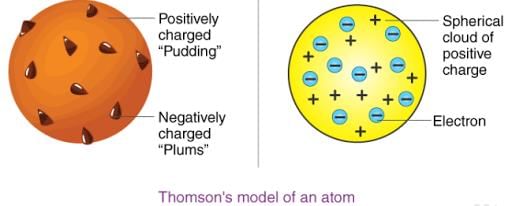
थॉमसन ने प्रस्तावित किया कि: (i) एक परमाणु एक सकारात्मक चार्ज वाली esfera में होता है और इलेक्ट्रॉन उसमें समाहित होते हैं। (ii) नकारात्मक और सकारात्मक चार्ज समान परिमाण में होते हैं। इसलिए, परमाणु समग्र रूप से विद्युत् तटस्थ होता है।
3. रदरफोर्ड का परमाणु मॉडल: रदरफोर्ड का अल्फा-कण बिखराव प्रयोग
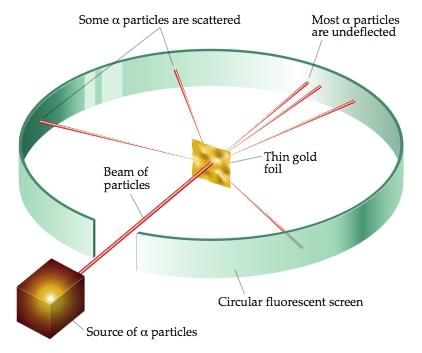
- रदरफोर्ड का अल्फा-कण बिखराव प्रयोग परमाणु नाभिक की खोज का कारण बना।
- रदरफोर्ड का परमाणु मॉडल प्रस्तावित करता है कि परमाणु के अंदर एक बहुत छोटा नाभिक होता है और इलेक्ट्रॉन इस नाभिक के चारों ओर परिक्रमा करते हैं।
इस मॉडल द्वारा परमाणु की स्थिरता को समझाया नहीं जा सका।
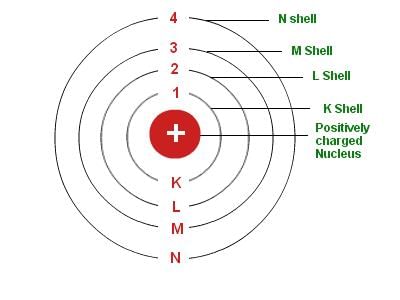
4. बोहर का मॉडल: नील्स बोहर का परमाणु मॉडल अधिक सफल रहा। उसने प्रस्तावित किया कि इलेक्ट्रॉन विभिन्न स्तरों में विभाजित होते हैं जिनकी ऊर्जा नाभिक के चारों ओर निश्चित होती है। यदि परमाणु के स्तर पूर्ण होते हैं, तो परमाणु स्थिर और कम प्रतिक्रियाशील होगा।
5. जेम्स चैडविक की खोज: जे. चैडविक ने परमाणु के नाभिक में न्यूट्रॉनों की उपस्थिति की खोज की। एक परमाणु के तीन उप-परमाण्विक कण हैं: (i) इलेक्ट्रॉन (ii) प्रोटॉन (iii) न्यूट्रॉन
इलेक्ट्रॉन नकारात्मक चार्ज वाले होते हैं, प्रोटॉन सकारात्मक चार्ज वाले होते हैं और न्यूट्रॉन का कोई चार्ज नहीं होता। एक इलेक्ट्रॉन का द्रव्यमान लगभग हाइड्रोजन परमाणु के द्रव्यमान का 1/2000 होता है। प्रोटॉन और न्यूट्रॉन का द्रव्यमान एक-एक इकाई माना जाता है।
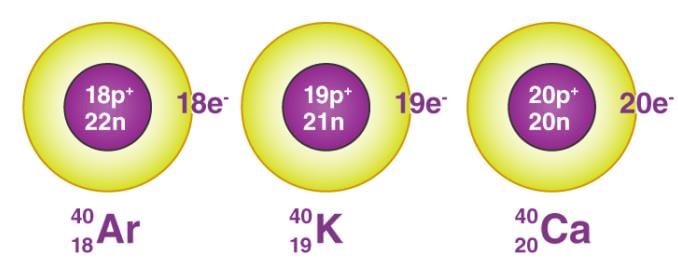
- हमें पता है कि प्रोटॉन परमाणु के नाभिक में उपस्थित होते हैं। यह एक परमाणु के प्रोटॉनों की संख्या होती है, जो इसके परमाणु संख्या को निर्धारित करती है। इसे ‘Z’ द्वारा दर्शाया जाता है। एक तत्व के सभी परमाणुओं का समान परमाणु संख्या Z होती है। वास्तव में, तत्वों को उनके प्रोटॉनों की संख्या द्वारा परिभाषित किया जाता है।
- एक परमाणु का द्रव्यमान मुख्यतः प्रोटॉनों और न्यूट्रॉनों के कारण होता है। ये सब परमाणु के नाभिक में उपस्थित होते हैं। इसलिए प्रोटॉन और न्यूट्रॉन को न्यूक्लियॉन भी कहा जाता है। इस प्रकार, एक परमाणु का द्रव्यमान इसके नाभिक में स्थित होता है।
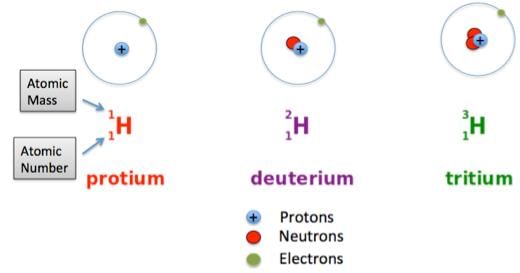
- आइसोटोप वे परमाणु होते हैं जो एक ही तत्व के होते हैं, लेकिन उनके द्रव्यमान संख्या में अंतर होता है।
- आइसोबार वे परमाणु होते हैं जिनकी द्रव्यमान संख्या समान होती है लेकिन परमाणु संख्या भिन्न होती है।
न्यूक्लियर बल
- एक नाभिक को एक साथ बांधने के लिए एक मजबूत आकर्षक बल होना आवश्यक है। यह बल इतना मजबूत होना चाहिए कि यह प्रोटॉनों (जो सकारात्मक चार्ज वाले होते हैं) के बीच के प्रतिकर्षण को पार कर सके और प्रोटॉनों और न्यूट्रॉनों को छोटे नाभिकीय आयतन में बांध सके। इस बल को न्यूक्लियर बल कहा जाता है।
- न्यूक्लियर बल कौलम्ब बल से कहीं अधिक मजबूत होता है जो चार्ज के बीच कार्य करता है या द्रव्यमानों के बीच कार्य करने वाले गुरुत्वाकर्षण बलों से भी अधिक होता है। न्यूट्रॉन-न्यूट्रॉन, प्रोटॉन-न्यूट्रॉन और प्रोटॉन-प्रोटॉन के बीच न्यूक्लियर बल लगभग समान होता है। न्यूक्लियर बल विद्युत चार्ज पर निर्भर नहीं करता।
रेडियोधर्मीता
- रेडियोधर्मिता तब होती है जब एक परमाणु नाभिक छोटे कणों में टूटता है। इसमें तीन प्रकार की नाभिकीय विकिरण होते हैं: अल्फा, बीटा, और गामा। अल्फा कण सकारात्मक चार्ज होते हैं, बीटा कण नकारात्मक चार्ज होते हैं, और गामा कण का कोई चार्ज नहीं होता है। विकिरणों में ऊर्जा के स्तर भी बढ़ते हैं: पहले अल्फा, फिर बीटा, और अंत में गामा, जो इन सब में सबसे ऊर्जा वाला होता है। अल्फा और बीटा कण होते हैं, जबकि गामा एक तरंग है। जब एक रेडियोधर्मी नाभिक बदलता है, तो शेष नाभिक (और परमाणु) वही नहीं होता जैसा पहले था। यह अपनी पहचान बदलता है। हाफ-लाइफ उस समय को वर्णित करता है जो किसी नमूने में आधे परमाणुओं के बदलने और आधे के समान रहने में लगता है। कार्बन का एक रेडियोधर्मी आइसोटोप भी है, कार्बन-14। सामान्य कार्बन कार्बन-12 होता है। C-14 में दो अतिरिक्त न्यूट्रॉन होते हैं और इसकी हाफ-लाइफ 5730 वर्ष होती है। वैज्ञानिक C-14 का उपयोग एक प्रक्रिया में करते हैं जिसे कार्बन डेटिंग कहा जाता है। यह प्रक्रिया तब नहीं होती जब दो कार्बन परमाणु एक रात मॉल में जाते हैं। कार्बन डेटिंग तब होती है जब वैज्ञानिक बहुत पुराने पदार्थों की उम्र मापने की कोशिश करते हैं। वातावरण में C-14 की बहुत छोटी मात्रा होती है। हर जीवित चीज में कुछ C-14 होता है। वैज्ञानिक उन चीजों में C-14 की संख्या मापते हैं जिन्हें वे खोदते हैं ताकि यह अनुमान लगा सकें कि वे कितनी पुरानी हैं। वे वस्तु की उम्र का निर्धारण करने के लिए 5730 वर्षों की हाफ-लाइफ पर निर्भर करते हैं।
फिशन और फ्यूजन प्रतिक्रियाएँ
- फिशन एक परमाणु का विभाजन है। सभी परमाणु फिशन के माध्यम से नहीं गुजरते हैं, वास्तव में, सामान्य परिस्थितियों में बहुत कम ऐसा करते हैं। एक नाभिकीय प्रतिक्रिया में, वैज्ञानिक यूरेनियम-235 परमाणुओं पर न्यूट्रॉनों की एक बड़ी संख्या फेंकते हैं। जब एक न्यूट्रॉन नाभिक पर लगता है, तो यूरेनियम U-236 बन जाता है। जब यह 236 में बदलता है, तो यूरेनियम परमाणु टूटने की इच्छा करता है। टूटने के बाद, यह तीन न्यूट्रॉन और बहुत सारी ऊर्जा छोड़ता है। ये न्यूट्रॉन क्षेत्र में तीन अन्य U परमाणुओं पर लगते हैं और उन्हें U-236 में बदल देते हैं। प्रत्येक चक्र में प्रतिक्रिया तीन गुना बढ़ जाती है। एक प्रतिक्रिया जो एक बार शुरू होने पर अपने आप जारी रहती है, उसे चेन रिएक्शन कहा जाता है। फ्यूजन वह प्रक्रिया है जिसमें दो छोटे परमाणु नाभिक एक साथ आते हैं और एक बड़ा स्थिर नाभिक बनाते हैं। उपयोग के लिए सबसे सरल नाभिक ड्यूटेरियम और ट्रिटियम (हाइड्रोजन के आइसोटोप) हैं।
गर्मी
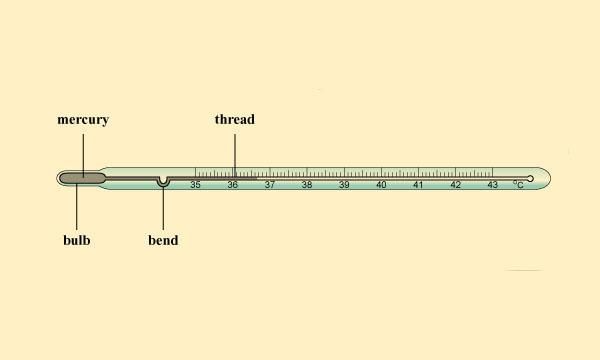
तापमानऊष्माजूल (J) में व्यक्त की जाती है, जबकि तापमान की SI इकाई केल्विन (K) है, और °C एक सामान्यतः उपयोग की जाने वाली तापमान की इकाई है। थर्मामीटरफारेनहाइटसेल्सियससेल्सियस तापमान (Tc) और फारेनहाइट तापमान (Tf) के बीच संबंध है: Tf = (9/5) Tc + 32।
सिद्धांत में, तापमान का कोई ऊपरी सीमा नहीं है, लेकिन एक निश्चित निम्न सीमा है - पूर्ण शून्य। यह सीमित तापमान सेल्सियस स्केल पर -273.16° के नीचे है। क्लिनिकल थर्मामीटरप्रयोगशाला थर्मामीटर का उपयोग करते हैं। इन थर्मामीटर की सीमा सामान्यतः -10°C से 110°C तक होती है। मानव शरीर का सामान्य तापमान 37°C होता है।
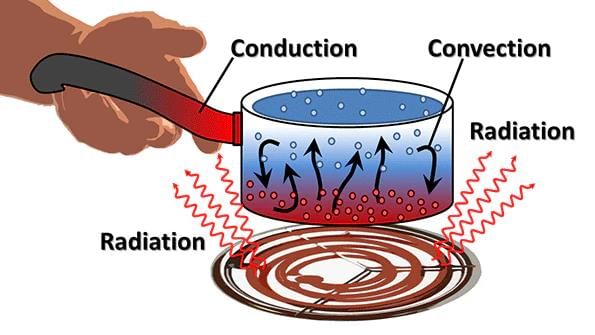
- ऊष्मासंवहन, संवहन, और विकिरण।
- (a) संवहन: वह प्रक्रिया जिसमें ऊष्मा एक वस्तु के गर्म सिरे से ठंडे सिरे तक स्थानांतरित होती है, संवहन कहलाती है। ठोस पदार्थों में, सामान्यतः ऊष्मा का स्थानांतरण संवहन द्वारा होता है। वे सामग्री जो ऊष्मा को आसानी से पास करने देती हैं, उन्हें ऊष्मा चालक कहा जाता है। उदाहरण: एल्यूमिनियम, लोहे और तांबा। जो सामग्री ऊष्मा को आसानी से पास नहीं करने देती हैं, वे खराब चालक होती हैं, जैसे प्लास्टिक और लकड़ी। खराब चालक को इन्सुलेटर कहा जाता है।
- (b) संवहन: ऊष्मा को एक स्थान से दूसरे स्थान पर वास्तविक तरल और गैसों की गति द्वारा ले जाया जाता है। तरल पदार्थों और गैसों में, ऊष्मा का स्थानांतरण संवहन द्वारा होता है। तटीय क्षेत्रों में रहने वाले लोग एक दिलचस्प घटना का अनुभव करते हैं। दिन के समय, भूमि पानी की तुलना में तेजी से गर्म हो जाती है। भूमि के ऊपर का हवा गर्म हो जाती है और ऊपर उठती है। समुद्र से ठंडी हवा भूमि की ओर बढ़ती है। भूमि से गर्म हवा समुद्र की ओर जाती है। समुद्र से आने वाली हवा को समुद्री ब्रीज़ कहा जाता है। रात में यह बिल्कुल विपरीत होता है। पानी भूमि की तुलना में अधिक धीरे-धीरे ठंडा होता है। इसलिए, भूमि से ठंडी हवा समुद्र की ओर जाती है। इसे भूमि ब्रीज़
- (c) विकिरण: विकिरण द्वारा ऊष्मा का स्थानांतरण किसी माध्यम की आवश्यकता नहीं होती है। यह तब भी हो सकता है जब कोई माध्यम मौजूद न हो। गहरे रंग की वस्तुएं हल्के रंग की वस्तुओं की तुलना में विकिरण को बेहतर तरीके से अवशोषित करती हैं। यही कारण है कि हम गर्मियों में हल्के रंग के कपड़ों में अधिक आरामदायक महसूस करते हैं। ऊनी कपड़े हमें सर्दियों में गर्म रखते हैं। ऐसा इसलिए है क्योंकि ऊन एक खराब ऊष्मा चालक है और इसमें तंतुओं के बीच हवा फंसी होती है।
- किसी शरीर का तापमान बदलने से उसके आयामों में बदलाव होता है। तापमान में वृद्धि के कारण किसी शरीर के आयामों में वृद्धि को थर्मल विस्तार कहा जाता है। लंबाई में विस्तार को रेखीय विस्तार कहा जाता है। क्षेत्र में विस्तार को क्षेत्र विस्तार कहा जाता है। आयतन में विस्तार को आयतन विस्तार कहा जाता है।
- 1° से तापमान बढ़ाने के लिए आवश्यक ऊष्मा ऊर्जा की मात्रा को उस पदार्थ की ऊष्मा क्षमता या थर्मल क्षमता कहा जाता है। इसकी SI इकाई (J/K) है।
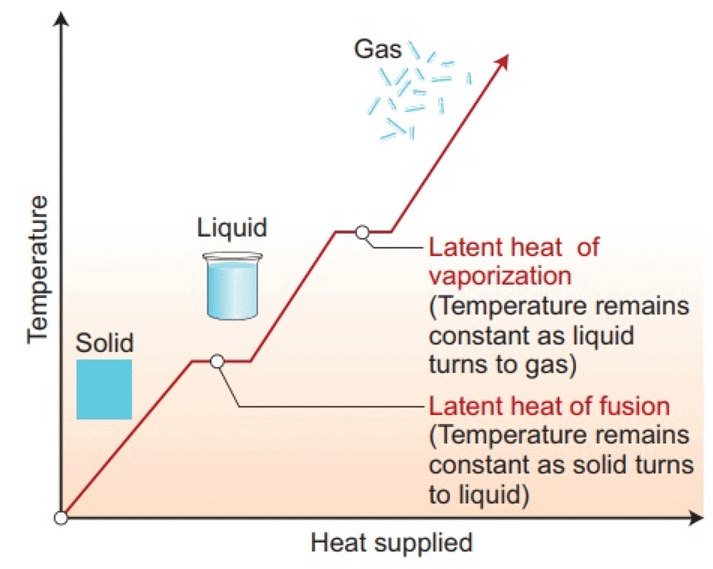
पार्श्विक ऊष्मा का चार्ट और वाष्पन
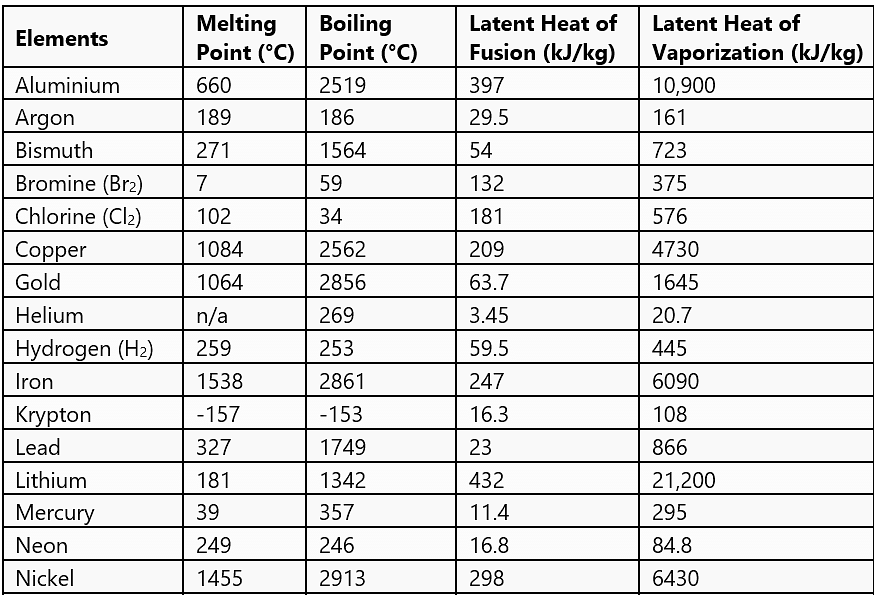
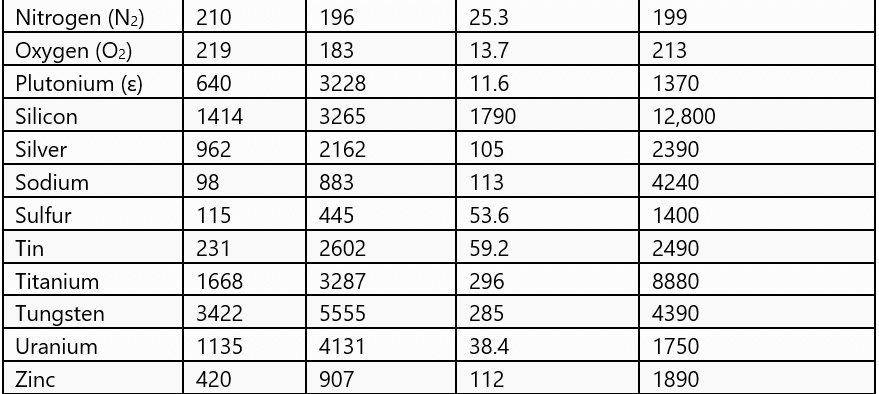
चयनित सामग्रियों के लिए सामान्य चरण परिवर्तन मात्राएँ
- कालोरीमेट्री का अर्थ है तापमान का मापन। जब एक उच्च तापमान वाला शरीर किसी अन्य शरीर के संपर्क में आता है जो कम तापमान का होता है, तो गर्म शरीर द्वारा खोया गया तापमान उस ठंडे शरीर द्वारा प्राप्त तापमान के बराबर होता है, बशर्ते कि कोई तापमान वातावरण में नहीं निकलने दिया जाए। जिस उपकरण में तापमान का मापन किया जा सकता है, उसे कालोरीमीटर कहा जाता है।
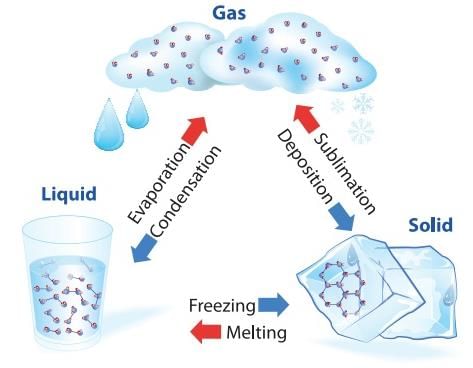
राज्य का परिवर्तन
- पदार्थ सामान्यतः तीन राज्यों में उपस्थित होता है: ठोस, तरल, और गैस। इन राज्यों में से एक से दूसरे में संक्रमण को राज्य का परिवर्तन कहा जाता है। दो सामान्य राज्य परिवर्तन ठोस से तरल और तरल से गैस (और इसके विपरीत) हैं। ये परिवर्तन तब होते हैं जब पदार्थ और इसके परिवेश के बीच तापमान का आदान-प्रदान होता है।
- पदार्थ का राज्य परिवर्तन: ठोस से तरल में परिवर्तन को पिघलना कहा जाता है और तरल से ठोस में परिवर्तन को संघनन कहा जाता है। यह देखा गया है कि तापमान तब तक स्थिर रहता है जब तक कि ठोस पदार्थ का संपूर्ण मात्रा पिघल नहीं जाता। अर्थात, ठोस और तरल दोनों अवस्थाएँ एक साथ थर्मल संतुलन में रहती हैं।
- जिस तापमान पर ठोस और तरल अवस्थाएँ एक दूसरे के साथ थर्मल संतुलन में होती हैं, उसे पिघलने का बिंदु कहा जाता है। यह पदार्थ का विशेष गुण है। यह दबाव पर भी निर्भर करता है। मानक वायुमंडलीय दबाव पर, किसी पदार्थ का पिघलने का बिंदु उसके सामान्य पिघलने का बिंदु कहलाता है।
- तरल से भाप (या गैस) में परिवर्तन को भाप बनाना कहा जाता है। यह देखा गया है कि तापमान तब तक स्थिर रहता है जब तक कि तरल की संपूर्ण मात्रा भाप में परिवर्तित नहीं हो जाती। अर्थात, तरल और भाप दोनों अवस्थाएँ एक साथ थर्मल संतुलन में रहती हैं।
- जिस तापमान पर तरल और भाप दोनों अवस्थाएँ एक साथ होती हैं, उसे उबालने का बिंदु कहा जाता है। ऊँचाई पर वायुमंडलीय दबाव कम होता है, जिससे पानी का उबलने का बिंदु समुद्र स्तर की तुलना में कम हो जाता है। दूसरी ओर, प्रेशर कुकर में दबाव बढ़ाकर उबलने के बिंदु को बढ़ाया जाता है, जिससे खाना जल्दी पकता है। मानक वायुमंडलीय दबाव पर, किसी पदार्थ का उबलने का बिंदु उसके सामान्य उबलने का बिंदु कहलाता है।
- हालांकि, सभी पदार्थ तीन राज्यों: ठोस-तरल-गैस से नहीं गुजरते हैं। कुछ पदार्थ सामान्यतः ठोस से सीधे भाप में जाते हैं और इसके विपरीत। ठोस अवस्था से भाप अवस्था में बिना तरल अवस्था में गुजरे परिवर्तन को सब्लिमेशन कहा जाता है, और पदार्थ को सब्लाइम कहा जाता है। सूखी बर्फ (ठोस CO2) सब्लाइम होती है, उसी तरह आयोडीन भी। सब्लाइमेशन प्रक्रिया के दौरान ठोस और भाप दोनों अवस्थाएँ थर्मल संतुलन में सह-अस्तित्व में रहती हैं।
- जब कोई पदार्थ राज्य परिवर्तन से गुजरता है, तब उसके और उसके परिवेश के बीच एक निश्चित मात्रा में तापीय ऊर्जा का आदान-प्रदान होता है। पदार्थ के राज्य परिवर्तन के दौरान प्रति एकक द्रव्यमान में स्थानांतरित होने वाली तापीय ऊर्जा की मात्रा को उस प्रक्रिया के लिए पदार्थ की छिपी हुई गर्मी कहा जाता है।
- ठोस को उसके पिघलने के बिंदु पर दी गई तापीय ऊर्जा, जिससे वह तरल अवस्था में परिवर्तित हो जाता है बिना किसी तापमान वृद्धि के, उसे पिघलने की छिपी हुई गर्मी कहा जाता है और तरल-गैस अवस्था परिवर्तन के लिए इसे भाप बनने की छिपी हुई गर्मी कहा जाता है।
- न्यूटन का शीतलन का नियम कहता है कि शरीर के ठंडा होने की दर उस शरीर के तापमान और परिवेश के तापमान के बीच के अतिरिक्त तापमान के समानुपाती है।
|
389 docs|527 tests
|
















