NCERT सारांश: रसायन विज्ञान - 3 का सारांश | UPSC CSE (हिंदी) के लिए पुरानी और नई एनसीईआरटी अवश्य पढ़ें PDF Download
2. वर्गीकरण
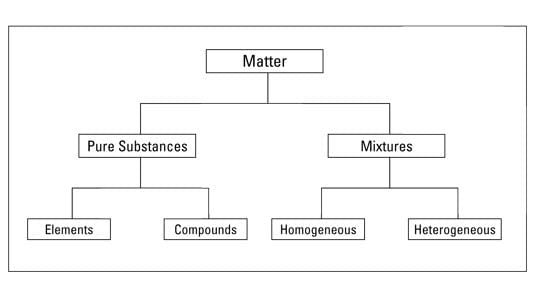
(क) शुद्ध पदार्थ और मिश्रण
- एक शुद्ध पदार्थ वह है जो अपने पूरे शरीर में एक ही प्रकार के पदार्थों को शामिल करता है। एक पदार्थ को किसी भी भौतिक प्रक्रिया द्वारा अन्य प्रकार के पदार्थों में नहीं बाँटा जा सकता।
- मिश्रण एक या एक से अधिक शुद्ध रूपों के पदार्थों से मिलकर बनता है। मिश्रण को शुद्ध पदार्थों में अलग किया जा सकता है जैसे कि फिल्ट्रेशन, सब्लिमेशन, डिकैंटेशन, क्रोमैटोग्राफी, क्रिस्टलाइजेशन आदि उचित पृथक्करण तकनीकों का उपयोग करके।
(ख) समान और असमान पदार्थ
- एक पदार्थ को समान कहा जाता है यदि इसका सभी भागों में एक ही और समान संघटन और गुण होते हैं। दूसरी ओर, यदि संघटन और गुण पूरे शरीर में समान नहीं हैं, तो पदार्थ असमान होता है। एक शुद्ध पदार्थ को समान होना चाहिए।
(ग) तत्व और यौगिक
शुद्ध पदार्थों को तत्वों और यौगिकों में वर्गीकृत किया जाता है:
- तत्व: तत्व एक ऐसे पदार्थ का रूप है जिसे रासायनिक प्रतिक्रियाओं द्वारा सरल पदार्थों में नहीं तोड़ा जा सकता। रॉबर्ट बॉयल पहले वैज्ञानिक थे जिन्होंने 1661 में तत्व की परिभाषा दी। तत्वों को सामान्यतः धातुओं, अधातुओं और धात्विक तत्वों में विभाजित किया जा सकता है।
- यौगिक: यौगिक एक ऐसा पदार्थ है जो दो या अधिक विभिन्न प्रकार के तत्वों से मिलकर बना होता है, जो निश्चित अनुपात में रासायनिक रूप से संयोजित होते हैं। यौगिक के गुण इसके घटक तत्वों से भिन्न होते हैं।
चिन्ह: चिन्ह तत्व के पूर्ण नाम का संक्षिप्त रूप है। कई मामलों में तत्व के सामान्य नाम के पहले अक्षर का उपयोग संक्षिप्त रूप के रूप में किया जाता है।
» H का अर्थ है हाइड्रोजन, N का अर्थ है नाइट्रोजन, आदि। यदि दो या अधिक तत्वों के लिए एक ही प्रारंभिक अक्षर होता है, तो उस प्रारंभिक अक्षर के साथ एक दूसरा प्रमुख अक्षर (छोटा) जोड़ा जाता है।
» Al का अर्थ है एल्युमिनियम, Cl का अर्थ है क्लोरीन, आदि। कुछ मामलों में, चिन्ह तत्व के लैटिन नाम से अक्षर या अक्षरों को लेकर बनाए जाते हैं। Cu का अर्थ है तांबा (लैटिन नाम Cuprum), Au का अर्थ है सोना (लैटिन नाम Aurum), आदि।
➢ चिन्हों का उपयोग करके प्रतिनिधित्व
- चिन्ह एक परमाणु का प्रतिनिधित्व करता है और स्वाभाविक रूप से संबंधित तत्व की एक निश्चित मात्रा का संकेत देता है। हर पदार्थ उसके अणुओं का संग्रह होता है, और पदार्थ के अणु का प्रतीकात्मक प्रतिनिधित्व उसकी सूत्र कहलाता है।
- तत्व के प्रति अणु में परमाणुओं की संख्या को अणुता (atomicity) कहा जाता है। यदि किसी तत्व का अणु एक परमाणु содержит है, तो अणु केवल चिन्ह द्वारा ही दर्शाया जाता है, अर्थात्, इस प्रकार के मामले में चिन्ह भी सूत्र का प्रतिनिधित्व करता है।
- वैलेन्सी: रासायनिक पदार्थों की संख्या, तत्वों को छोड़कर, इन प्राथमिक सामग्रियों के दो या अधिक संयोजित रूपों से मिलकर बनती है।
एक तत्व की वैलेन्सी उस तत्व के एक परमाणु की संयोजक क्षमता है और इसे उन हाइड्रोजन परमाणुओं की संख्या से मापा जाता है, जिनके साथ इसे संयोजित किया जा सकता है।
हाइड्रोजन को संदर्भ के मानक के रूप में चुना गया है क्योंकि इसका संयोजन क्षमता सबसे कम है। हालांकि किसी तत्व के परमाणु का संयोजन क्षमता सामान्यतः निश्चित होती है, वैलेंसी भिन्न हो सकती है, कुछ तत्वों में भिन्न वैलेंसियाँ होती हैं। ज्ञात सबसे उच्च वैलेंसी 0 है, और वैलेंसियाँ 0 से लेकर 8 के बीच होती हैं। हीलियम, आर्गन आदि, जिन्हें निष्क्रिय गैसें कहा जाता है, का कोई संयोजन क्षमता नहीं है और इसलिए उन्हें शून्य-वैल्येंट तत्व माना जाता है। वैलेंसी हमेशा एक पूर्णांक होती है। यौगिक भी तत्वों की तरह अणु सूत्र द्वारा प्रदर्शित होते हैं। किसी यौगिक का सूत्र बनाने के लिए, उसके घटक तत्वों के प्रतीक एक साथ लिखे जाते हैं और प्रत्येक के परमाणुओं की संख्या को प्रतीकों के नीचे दाईं ओर अंक लिखकर दर्शाया जाता है। लेकिन सूत्र में उपसूचकांक एक नहीं लिखा जाता है।
- यौगिक भी तत्वों की तरह अणु सूत्र द्वारा प्रदर्शित होते हैं। किसी यौगिक का सूत्र बनाने के लिए, उसके घटक तत्वों के प्रतीक एक साथ लिखे जाते हैं और प्रत्येक के परमाणुओं की संख्या को प्रतीकों के नीचे दाईं ओर अंक लिखकर दर्शाया जाता है। लेकिन सूत्र में उपसूचकांक एक नहीं लिखा जाता है।
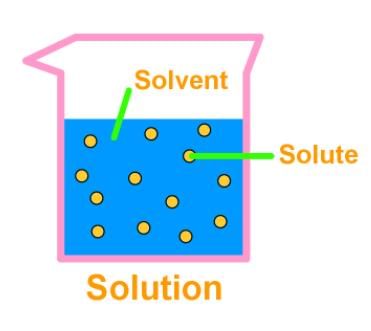
3. समाधान
- एक समाधान दो या दो से अधिक पदार्थों का एक समरूप मिश्रण होता है। समाधान का प्रमुख घटक सॉल्वेंट कहलाता है, और गौण घटक सॉल्यूट कहलाता है। नींबू पानी, सोडा पानी आदि सभी समाधान के उदाहरण हैं। हमारे पास ठोस समाधान (धातु मिश्र धातु) और गैसीय समाधान (वायु) भी हो सकते हैं।
- समाधान के कण 1 नैनोमीटर (10^-9 मीटर) से छोटे होते हैं। इसलिए, उन्हें नग्न आंखों से नहीं देखा जा सकता। सॉल्यूट कणों को मिश्रण से फिल्ट्रेशन की प्रक्रिया द्वारा अलग नहीं किया जा सकता। सॉल्यूट कण बिना हिलाए छोड़ने पर नीचे नहीं बैठते, अर्थात्, एक समाधान स्थिर होता है।
- एक समाधान की सांद्रता वह मात्रा है जो सॉल्यूट प्रति यूनिट आयतन या समाधान/सॉल्वेंट के प्रति यूनिट मास में उपस्थित होती है।
- ऐसे पदार्थ जो सॉल्वेंट में अघुलनशील होते हैं और जिनके कण नग्न आंखों से दिखाई देते हैं, वे सस्पेंशन बनाते हैं। एक सस्पेंशन एक विषम मिश्रण होता है।
4. मिश्र धातुएं
- मिश्र धातुएं धातुओं का समरूप मिश्रण होती हैं और इन्हें भौतिक विधियों द्वारा उनके घटकों में नहीं बांटा जा सकता। फिर भी, एक मिश्र धातु को एक मिश्रण माना जाता है क्योंकि यह अपने घटकों के गुण प्रदर्शित करती है और इसकी संरचना में परिवर्तनशीलता हो सकती है। उदाहरण: पीतल लगभग 30% जस्ता और 70% तांबा का मिश्रण है।
- गैर-समरूप प्रणाली, जिसमें ठोस तरल में बिखरे होते हैं, उन्हें सस्पेंशन कहा जाता है। एक सस्पेंशन एक विषम मिश्रण होता है जिसमें सॉल्यूट कण घुलते नहीं हैं बल्कि माध्यम के पूरे भाग में लटके रहते हैं। सस्पेंशन के कण नग्न आंखों से दिखाई देते हैं।
- कोलॉयड्स विषम मिश्रण होते हैं जिनमें कणों का आकार इतना छोटा होता है कि उन्हें नग्न आंखों से नहीं देखा जा सकता, लेकिन वे प्रकाश को बिखेरने के लिए काफी बड़े होते हैं। कोलॉयड्स उद्योग और दैनिक जीवन में उपयोगी होते हैं। कणों को बिखरे हुए चरण कहा जाता है और जिस माध्यम में वे वितरित होते हैं उसे वितरण माध्यम कहा जाता है।
5. धातुएं और अधातुएं
तत्वों को सामान्यतः धातुओं, अधातुओं और धातुविज्ञानियों में विभाजित किया जा सकता है। धातुएं आमतौर पर निम्नलिखित गुणों में से कुछ या सभी को प्रदर्शित करती हैं:
धातुओं में चमक होती है। अपवाद: पारा, हालाँकि यह एक धातु है, तरल है।
- इनका रंग चांदी-ग्रे या सोने के पीले रंग का होता है।
- ये गर्मी और बिजली का संचालन करते हैं। चाँदी सबसे अच्छी होती है जबकि तांबा दूसरे स्थान पर है।
- ये डक्टाइल (तारों में खींचे जा सकते हैं) होते हैं। सोना सबसे अधिक डक्टाइल धातु है।
- ये मैलियाबल (पतली चादरों में पीटे जा सकते हैं) होते हैं। अपवाद: एंटीमनी और बिस्मथ जैसी धातुएँ भंगुर होती हैं।
- ये सोनोरस (हिट करने पर घंटी की आवाज़ करते हैं) होते हैं।
- धातुओं के उच्च गलनांक होते हैं। अपवाद: गैलियम और सीज़ियम के बहुत कम गलनांक होते हैं।
- धातुएँ सकारात्मक आयन बनाने के लिए गैर-धातुओं को इलेक्ट्रॉन खोकर मिलती हैं।
- इलेक्ट्रोलाइसिस में, धातुएँ नकारात्मक इलेक्ट्रोड (कैथोड) पर जमा होती हैं।
- धातुएँ ऑक्सीजन के साथ मिलकर बुनियादी ऑक्साइड बनाती हैं। एल्यूमिनियम ऑक्साइड और जिंक ऑक्साइड दोनों बुनियादी और अम्लीय ऑक्साइड के गुण दिखाते हैं। इन ऑक्साइड को अम्पीटेरिक ऑक्साइड कहा जाता है।
- विभिन्न धातुएँ ऑक्सीजन के प्रति विभिन्न प्रतिक्रियाएँ दिखाती हैं।
- पोटेशियम और सोडियम जैसी धातुएँ इतनी तेजी से प्रतिक्रिया करती हैं कि वे खुली हवा में आग पकड़ लेती हैं। इसलिए, उन्हें सुरक्षित रखने और आकस्मिक आग से बचाने के लिए, उन्हें केरोसीन तेल में डूबा कर रखा जाता है।
- विभिन्न धातुओं की पानी और पतले अम्लों के साथ विभिन्न प्रतिक्रियाएँ होती हैं।
- गतिविधि श्रृंखला में हाइड्रोजन से ऊपर की धातुएँ पतले अम्लों से हाइड्रोजन को विस्थापित कर सकती हैं और लवण बनाती हैं।
- धातुएँ प्रकृति में स्वतंत्र तत्वों या उनके यौगिकों के रूप में पाई जाती हैं। धातुओं को उनके अयस्कों से निकालना और फिर उपयोग के लिए शुद्ध करना धातुविज्ञान के रूप में जाना जाता है।
- कुछ धातुओं, जैसे लोहे, की सतह को लंबे समय तक नमी भरे हवा के संपर्क में आने पर क्षय होता है। इस घटना को क्षय कहा जाता है।

कार्बनिक रसायनशास्त्र
- कार्बनिक रसायनशास्त्र वह शाखा है जो हाइड्रोजन (हाइड्रोकार्बन) के साथ कार्बन के यौगिकों का अध्ययन करती है, और उनके व्युत्पन्नों का। वर्तमान में लगभग पांच मिलियन कार्बनिक यौगिक ज्ञात हैं।
- कार्बनिक यौगिकों में मुख्यतः हाइड्रोजन और कार्बन होते हैं। इसलिए, कार्बनिक रसायनशास्त्र को हाइड्रोकार्बन और उनके व्युत्पन्नों के अध्ययन के रूप में परिभाषित किया गया है।
- अधिकांश परमाणु केवल छोटे अणुओं का निर्माण करने में सक्षम होते हैं। हालाँकि, एक या दो बड़े अणुओं का निर्माण कर सकते हैं।
- बड़े अणुओं के निर्माण के लिए सर्वश्रेष्ठ परमाणु कार्बन है। कार्बन ऐसे अणुओं का निर्माण कर सकता है जिनमें दस, सौ, हजार और यहां तक कि लाखों परमाणु होते हैं!
- संभव संयोजनों की विशाल संख्या का अर्थ है कि कार्बन यौगिकों की संख्या सभी अन्य तत्वों के यौगिकों की तुलना में अधिक है!
- एकल कार्बन परमाणु चार अन्य परमाणुओं के साथ संयोजित होने में सक्षम है। हम कहते हैं कि इसकी वालेंसी 4 है। कभी-कभी एक कार्बन परमाणु कम परमाणुओं के साथ संयोजित होता है।
- कार्बन परमाणु उन कुछ में से एक है जो अपने साथ संयोजित हो सकता है। दूसरे शब्दों में, कार्बन अन्य कार्बन परमाणुओं के साथ संयोजित होता है।
- इसका अर्थ है कि कार्बन परमाणु श्रृंखलाएँ और रिंग बना सकते हैं, जिन पर अन्य परमाणु जुड़े हो सकते हैं। यह विभिन्न यौगिकों की एक विशाल संख्या की ओर ले जाता है।
- कार्बनिक रसायनशास्त्र मूलतः कार्बन का रसायनशास्त्र है। कार्बन यौगिकों को इस आधार पर वर्गीकृत किया जाता है कि कार्बन परमाणु किस प्रकार व्यवस्थित हैं और कौन से अन्य परमाणु समूह जुड़े हुए हैं।
➢ हाइड्रोकार्बन
सरलतम कार्बनिक यौगिक केवल कार्बन और हाइड्रोजन परमाणुओं से बने होते हैं। यहाँ तक कि इनकी संख्या हजारों में है! केवल कार्बन और हाइड्रोजन के यौगिकों को हाइड्रोकार्बन कहा जाता है।
1. अल्केन
अल्केन में, कार्बन की चार वैलेन्सी बांड विभिन्न परमाणुओं के साथ जुड़ी होती हैं। इन प्रकार के बांडों को सिंगल बांड कहा जाता है और ये सामान्यतः स्थिर होते हैं तथा अन्य रासायनिक तत्वों के हमले के प्रति प्रतिरोधी होते हैं। अल्केन में अधिकतम संख्या में हाइड्रोजन परमाणु होते हैं। इन्हें सैचुरेटेड कहा जाता है। सबसे सरल हाइड्रोकार्बन है:
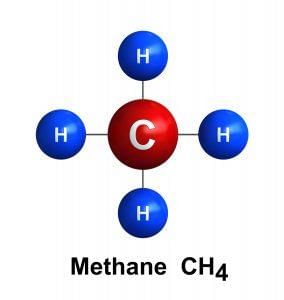
- मीथेन: CH4, यह हाइड्रोकार्बनों की श्रृंखला का सबसे सरल सदस्य है। श्रृंखला के प्रत्येक उत्तराधिकारी सदस्य में पिछले सदस्य की तुलना में एक अधिक कार्बन परमाणु होता है।
- एथेन: C2H6
- प्रोपेन (हीटिंग फ्यूल): C3H8
- ब्यूटेन (लाइटर / कैम्पिंग फ्यूल): C4H10
- पेंटेन: C5H12
- हैक्सेन: C6H14
पॉलीथीन एक बहुत बड़ा अल्केन है जिसमें एक ही अणु में लाखों परमाणु होते हैं। ज्वलनशील होने के अलावा, अल्केन स्थिर यौगिक हैं जो भूमिगत पाए जाते हैं।
2. अल्कीन
एक और यौगिकों की श्रृंखला को अल्कीन कहा जाता है। इनका सामान्य सूत्र है: CnH2n। इन यौगिकों के नामकरण का तरीका अल्केन के समान है, केवल प्रत्यय में एक का अंतर है। अल्कीन में अल्केन की तुलना में कम हाइड्रोजन परमाणु होते हैं। अतिरिक्त वैलेन्सी जो बचती है, वे एक जोड़ी कार्बन परमाणुओं के बीच डबल बांड के रूप में होती हैं। डबल बांड सिंगल बांड की तुलना में अधिक प्रतिक्रियाशील होते हैं, जिससे अल्कीन रासायनिक रूप से अधिक प्रतिक्रियाशील होते हैं। सबसे सरल अल्कीन नीचे सूचीबद्ध हैं:
एथीन (औद्योगिक प्रारंभिक रासायनिक): C2H4
प्रोपीन: C3H6
ब्यूटीन: C4H8
पेंटीन: C5H10
हेक्सीन: C6H12
हेक्सीन का संरचनात्मक सूत्र
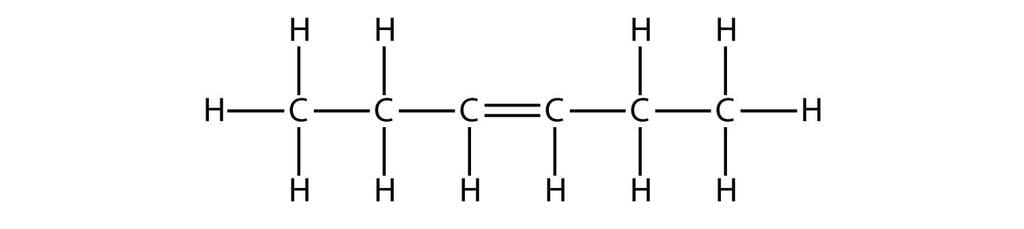
3. अल्काइन्स
तीसरी श्रृंखला अल्काइन्स हैं। इनका सूत्र है: CnH2n-2
ये अत्यधिक प्रतिक्रियाशील पदार्थ हैं जिनका कई औद्योगिक उपयोग हैं। इन यौगिकों का नामकरण अल्केन्स के समान है, सिवाय इसके कि प्रत्यय -yne है। अल्काइन्स में दो कार्बन परमाणु तीन गुना बंधन द्वारा जुड़े होते हैं। यह अत्यधिक प्रतिक्रियाशील होते हैं, जिससे ये यौगिक अस्थिर बन जाते हैं। अल्काइन्स के उदाहरण हैं:
- एथाइन - जिसे ऐसिटिलीन के नाम से जाना जाता है, जिसका उपयोग पानी के नीचे वेल्डिंग के लिए किया जाता है: C2H2
- प्रोपाइन: C3H4
- ब्यूटाइन: C4H6
- पेंटाइन: C5H8
- हेक्साइन: C6H10
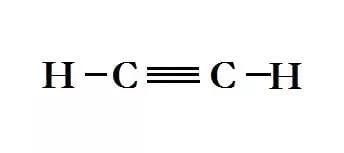
अल्केन, अल्केन और अल्काइन सभी में कार्बन परमाणु रैखिक श्रृंखलाओं में होते हैं। जब श्रृंखलाओं के साथ छल्ले मिलाए जाते हैं, तो हाइड्रोकार्बनों की संख्या लगभग अनंत हो जाती है। छल्लों में व्यवस्थित हाइड्रोकार्बन भी होते हैं।
कुछ उदाहरण निम्नलिखित हैं:
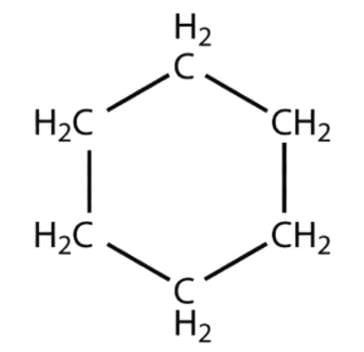
- साइक्लोहेक्सेन - एक संतृप्त हाइड्रोकार्बन जिसमें परमाणु हेक्सागोनल छल्ले में व्यवस्थित होते हैं: C6H12
- बेंजीन - एक औद्योगिक सॉल्वेंट। बेंजीन रिंग कार्बनिक रसायन विज्ञान में सबसे महत्वपूर्ण संरचनाओं में से एक है। वास्तव में, इसकी वैकल्पिक दोहरी और एकल बंधन रिंग के चारों ओर "फैल गई" हैं ताकि अणु सममित हो: C6H6
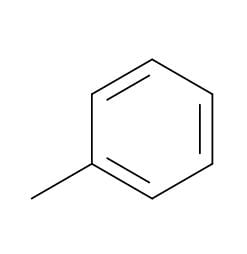
- टोल्यून - एक महत्वपूर्ण सॉल्वेंट और प्रारंभिक रासायनिक: C7H8
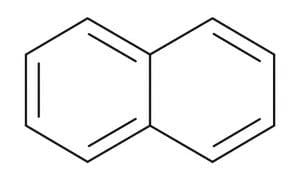
- नाफ्थालीन - जो मोथबॉल में उपयोग होता है। इसे दो जुड़े बेंजीन रिंगों के रूप में दर्शाया जा सकता है: C10H8
➢ कार्बन, हाइड्रोजन और ऑक्सीजन
जब ऑक्सीजन परमाणु जोड़े जाते हैं, तो यौगिकों की विविधता अत्यधिक बढ़ जाती है। यहां कुछ उदाहरण दिए गए हैं जहां प्रत्येक अणु में एकल कार्यात्मक समूह है:
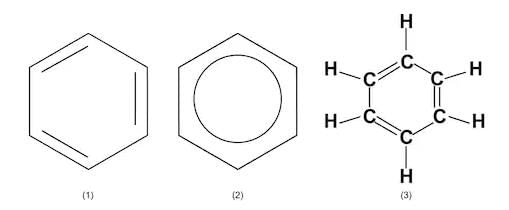
- अल्कोहल्स: अल्कोहल्स में OH (हाइड्रॉक्सिल) समूह होता है। ऐसे परमाणुओं का समूह जो एक जैविक श्रृंखला को उसकी विशिष्ट विशेषता देता है, उसे कार्यात्मक समूह कहा जाता है। इनकी सामान्य सूत्र है: CnH2n+1OH। उदाहरण:
- (i) मीथेनॉल (लकड़ी का अल्कोहल) CH3OH
- (ii) एथेनॉल (पीने का अल्कोहल) C2H5OH
- (iii) फिनोल (कार्बोलिक एसिड - एक कीटाणुनाशक के रूप में उपयोग किया जाता है) C6H5OH
- ईथर्स: ईथर्स में O परमाणु दो हाइड्रोकार्बन श्रृंखलाओं से जुड़ा होता है। इनकी सामान्य सूत्र है: (CnH2n+1)2O। उदाहरण:
- (i) डाइमिथाइल ईथर (एक गैस) (CH3)2O
- (ii) डाईएथिल ईथर (एक तरल जो एनस्थेटिक के रूप में उपयोग होता है) (C2H5)2O
- कीटोन: कीटोन में CO समूह दो हाइड्रोकार्बन श्रृंखलाओं से जुड़ा होता है। इनकी सामान्य सूत्र है: (CnH2n+1)2CO। उदाहरण: डाइमिथाइल कीटोन (जिसे एसीटोन भी कहा जाता है: नाखून के वार्निश रिमूवर), CH3COCH3
- एल्डिहाइड्स: एल्डिहाइड्स में CHO समूह एक हाइड्रोकार्बन श्रृंखला से जुड़ा होता है। इनकी सामान्य सूत्र है: CnH2n+1CHO। उदाहरण:
- (i) फॉर्मल्डिहाइड (प्रयोगशालाओं में संरक्षक) - HCHO
- (ii) एसीटाल्डिहाइड - CH3CHO
- फैटी एसिड्स: फैटी एसिड्स में CO2H (या COOH) समूह एक हाइड्रोकार्बन श्रृंखला या रिंग से जुड़ा होता है। इनकी सामान्य सूत्र है: CnH2n+1CO2H। उदाहरण:
- (i) फॉर्मिक एसिड (चींटी के काटने और उकसाने वाली बिच्छू में) - HCO2H
- (ii) एसीटिक एसिड (सिरका) - CH3CO2H
- (iii) ब्यूटिरिक एसिड (खट्टी मक्खन की गंध) - C2H5CO2H
एक अणु पर दो या अधिक कार्यात्मक समूह होना संभव है। ये समान समूह हो सकते हैं (जैसे ऑक्सालिक एसिड - एक विष जो रूबर्ब के पत्तों में पाया जाता है - जिसमें दो फैटी एसिड समूह होते हैं) या विभिन्न (जैसे हाइड्रॉक्सीएथेनोइक एसिड - जिसमें एक हाइड्रॉक्सिल समूह और एक फैटी एसिड समूह होता है): ऑक्सालिक एसिड - (COOH)2, हाइड्रॉक्सीएथेनोइक एसिड - CH2OHCOOH।
कार्बन, हाइड्रोजन और ऑक्सीजन से युक्त सबसे प्रसिद्ध यौगिकों को कार्बोहाइड्रेट कहा जाता है। एक उदाहरण सामान्य चीनी, सुक्रोज़ (C12H22O11) है।
➢ आइसोमेरिज़्म
➢ आइसोमरिज़्म
- कार्बनिक अणुओं के साथ एक दिलचस्प घटना को आइसोमरिज़्म कहा जाता है। आइए दो यौगिकों पर नज़र डालते हैं जो पहले पेश किए गए थे: डाइमिथाइल ईथर (CH3)2O और एथेनॉल C2H5OH। पहला एक गैस है जिसे अगर इनहेल किया जाए तो यह आपको बेहोश कर देगा। दूसरा सामान्य शराब है जो मदिरा में पी जाती है। दोनों यौगिकों में 2 कार्बन अणु, 6 हाइड्रोजन अणु और 1 ऑक्सीजन अणु है।
- हालांकि अणु समान हैं, लेकिन उनका व्यवस्थितकरण अलग है। इससे समान संख्या के अणुओं के साथ दो विभिन्न यौगिक प्राप्त होते हैं। ये यौगिक आइसोमर होते हैं और इस घटना को आइसोमरिज़्म कहा जाता है। आइसोमरिज़्म कार्बनिक यौगिकों की संख्या बढ़ाता है। एक यौगिक में जितने अधिक कार्बन अणु होते हैं, अणुओं को व्यवस्थित करने के अधिक तरीके होते हैं और आइसोमर की संख्या भी बढ़ती है।
➢ नाइट्रोजन यौगिक
- नाइट्रोजन जोड़ना: कई, बहुत महत्वपूर्ण कार्बनिक यौगिक नाइट्रोजन содержित हैं। इससे यौगिकों की और अधिक श्रृंखला बनती है। (a) एमाइन (एमाइन में अमोनिया (NH3) के एक या अधिक हाइड्रोजन अणुओं को हाइड्रोकार्बन श्रृंखला या रिंग द्वारा प्रतिस्थापित किया जाता है)। इनका सामान्य सूत्र है: CnH2n+1NH2। उदाहरण: (i) मेथिलामाइन (एक तीखा, पानी में घुलनशील गैस)- CH3NH2 (ii) साइनाइड्स (साइनाइड्स में CN समूह होता है) » इनका सामान्य सूत्र है: CnH2n+1CN उदाहरण: मेथिल साइनाइड- CH3CN (iii) एमिनो एसिड्स (एमिनो एसिड्स में दो कार्यात्मक समूह होते हैं: एमीने (HN2) समूह और वसायुक्त एसिड (COOH) समूह » इनका सामान्य सूत्र है: CnH2nNH2COOH उदाहरण: ग्लाइसिन (सबसे सरल एमिनो एसिड)- CH2NH2COOH (iv) एक प्रसिद्ध यौगिक जिसमें नाइट्रोजन है, ट्रिनिट्रो टोल्यूएन (C6H2CH3(NO)3) है - जिसे आमतौर पर TNT के संक्षिप्त रूप में जाना जाता है)। यह एक कृत्रिम रूप से निर्मित विस्फोटक है।
अधिकतर कार्बनिक यौगिक कार्बन, हाइड्रोजन, ऑक्सीजन और नाइट्रोजन को शामिल करते हैं। अन्य प्रकार के अणु भी शामिल किए जा सकते हैं ताकि और अधिक यौगिक बन सकें। इनमें फास्फोरस, सल्फर (उदाहरण: थियामिन), क्लोरीन (उदाहरण: क्लोरोफिल-CHCl3, डाइक्लोरो डाइफेनिल ट्राईक्लोरो मीथेन – DDT C14H9Cl15) और लोहे (उदाहरण: हीमोग्लोबिन) जैसे अणु शामिल हो सकते हैं।
तत्वों का आवधिक वर्गीकरण
- तत्वों को समान गुणों के आधार पर एक साथ समूहित करना और असमान गुणों वाले तत्वों को अलग करना तत्वों का वर्गीकरण कहलाता है। तत्वों को उनके गुणों के आधार पर वर्गीकृत करने वाली तालिका को आवधिक तालिका कहा जाता है।
- डोबेरेइनर ने तत्वों को त्रैकों में समूहित किया और न्यूलैंड्स ने ऑक्टेव का नियम दिया। मेंडेलीव ने तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में और उनके रासायनिक गुणों के अनुसार व्यवस्थित किया।
- डोबेरेइनर के त्रैकों में तत्वों को परमाणु द्रव्यमान के बढ़ते क्रम में तीन के समूह में व्यवस्थित किया गया। मध्य तत्व का परमाणु द्रव्यमान अन्य दो तत्वों का अंकगणितीय औसत था।
- न्यूलैंड का ऑक्टेव का नियम कहता है कि जब तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित किया जाता है, तो आठवां तत्व पहले तत्व के भौतिक और रासायनिक गुणों के समान होता है, जैसे संगीत की सरणी में आठवां नोट पहले नोट के समान होता है।
- मेंडेलीव का आवधिक नियम कहता है कि तत्वों के भौतिक और रासायनिक गुण उनके परमाणु द्रव्यमान के आवधिक फलन होते हैं। मेंडेलीव ने आवधिक तालिका में उनके स्थान के आधार पर कुछ तत्वों के परमाणु द्रव्यमान को सही किया।
- मेंडेलीव ने अपने आवधिक तालिका में कुछ अभी तक खोजे गए तत्वों के अस्तित्व की भविष्यवाणी की थी। मेंडेलीव की आवधिक तालिका में ऊर्ध्वाधर स्तंभ होते हैं जिन्हें 'समूह' कहा जाता है और क्षैतिज पंक्तियाँ होती हैं जिन्हें 'अवधि' कहा जाता है।
- आवधिक तालिका विकसित करते समय, कुछ मामलों में मेंडेलीव को एक तत्व को थोड़ा अधिक परमाणु द्रव्यमान वाले तत्व से पहले रखना पड़ा। इस प्रकार तत्वों को समान गुणों के आधार पर एकत्रित किया जा सका।
- मेंडेलीव की तालिका ने हाइड्रोजन या लैंथेनाइड्स और एक्टिनाइड्स और आइसोटोप के लिए उचित स्थान नहीं दिया। सभी तत्वों के आइसोटोप ने मेंडेलीव के आवधिक नियम को चुनौती दी।
- एक और समस्या यह थी कि परमाणु द्रव्यमान एक तत्व से दूसरे तत्व की ओर बढ़ने पर नियमित रूप से नहीं बढ़ता। इसलिए यह अनुमान लगाना संभव नहीं था कि दो तत्वों के बीच कितने तत्वों की खोज की जा सकती है - विशेष रूप से जब हम भारी तत्वों पर विचार करते हैं।
- 1913 में, हेनरी मोस्ले ने दिखाया कि किसी तत्व का परमाणु संख्या उसके परमाणु द्रव्यमान से अधिक मूलभूत विशेषता है। इसके अनुसार, मेंडेलीव का आवधिक नियम संशोधित किया गया और आधुनिक आवधिक तालिका और आधुनिक आवधिक नियम के आधार के रूप में परमाणु संख्या को अपनाया गया।
- ऊर्ध्वाधर स्तंभों को समूह कहा जाता है, जबकि क्षैतिज पंक्तियों को अवधि कहा जाता है। नॉबल गैसें तालिका के सबसे दाएं होती हैं और तालिका के सबसे बाएं होते हैं क्षारीय धातुएं। संक्रमण तत्व मध्य में B उपसमूहों में रखे जाते हैं। आंतरिक संक्रमण तत्व - लैंथेनाइड्स और एक्टिनाइड्स, आवधिक तालिका के नीचे दो अलग-अलग श्रृंखलाओं में रखे जाते हैं।
- समूह संख्या वह इलेक्ट्रॉनों की संख्या है जो वैलेंस शेल में होती है। समान वैलेंस संख्या वाले तत्व एक साथ समूहित होते हैं। परमाणु में उपस्थित शेलों की संख्या अवधि संख्या को देती है।
- परमाणु आकार: परमाणु आकार का तात्पर्य किसी परमाणु के व्यास से है। परमाणु आकार को एक अलग परमाणु के कक्षीय शेल और नाभिक के केंद्र के बीच की दूरी के रूप में देखा जा सकता है।
|
389 docs|527 tests
|















