NCERT सारांश: रसायन विज्ञान - 3 का सारांश | UPSC CSE (हिंदी) के लिए पुरानी और नई एनसीईआरटी अवश्य पढ़ें PDF Download
2. वर्गीकरण
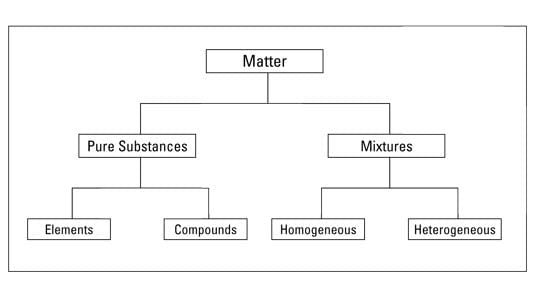
(a) शुद्ध पदार्थ और मिक्सचर
- शुद्ध पदार्थ वह होता है जिसमें पूरे शरीर में एक ही प्रकार के सामग्री होते हैं। किसी पदार्थ को किसी भी भौतिक प्रक्रिया द्वारा अन्य प्रकार के पदार्थों में नहीं विभाजित किया जा सकता।
- मिक्सचर एक से अधिक प्रकार के शुद्ध पदार्थों से मिलकर बनता है, जिसे पदार्थ के रूप में जाना जाता है। मिक्सचर को उचित विभाजन तकनीकों जैसे कि फिल्ट्रेशन, सब्लिमेशन, डिकैंटेशन, क्रोमैटोग्राफी, क्रिस्टलाइजेशन आदि का उपयोग करके शुद्ध पदार्थों में विभाजित किया जा सकता है।
(b) समवर्ती और असमवर्ती पदार्थ
- यदि किसी पदार्थ के सभी भागों में एक ही और समान संघटन और गुण होते हैं, तो उसे समवर्ती कहा जाता है। दूसरी ओर, यदि संघटन और गुण पूरे पदार्थ में समान नहीं हैं, तो वह असमवर्ती होता है। एक शुद्ध पदार्थ हमेशा समवर्ती होना चाहिए।
(c) तत्त्व और संयुक्त
शुद्ध पदार्थों को तत्वों और यौगिकों में वर्गीकृत किया जाता है:
- तत्व: तत्व एक ऐसा पदार्थ है जिसे रासायनिक प्रतिक्रियाओं द्वारा सरल पदार्थों में नहीं तोड़ा जा सकता। रॉबर्ट बॉयल पहले वैज्ञानिक थे जिन्होंने 1661 में तत्व शब्द का उपयोग किया। तत्वों को सामान्यतः धातुओं, अधातुओं और धातु-पदार्थों में विभाजित किया जा सकता है।
- यौगिक: यौगिक एक ऐसा पदार्थ है जो दो या अधिक विभिन्न प्रकार के तत्वों से मिलकर बना होता है, जो निश्चित अनुपात में रासायनिक रूप से संयोजित होते हैं। यौगिक के गुण इसके घटक तत्वों से भिन्न होते हैं।
प्रतीक: प्रतीक किसी तत्व के पूर्ण नाम का संक्षिप्त रूप होता है। कई मामलों में तत्व के सामान्य नाम का प्रारंभिक बड़ा अक्षर इसका संक्षिप्त रूप होता है।
» H हाइड्रोजन के लिए, N नाइट्रोजन के लिए, आदि। दो या दो से अधिक तत्वों के लिए समान प्रारंभिक अक्षर होने पर दो अक्षरों का उपयोग किया जाता है। प्रारंभिक अक्षर के साथ उसके नाम का दूसरा प्रमुख अक्षर (छोटा) जोड़ा जाता है।
» Al एल्युमिनियम के लिए, Cl क्लोरीन के लिए, आदि। कुछ मामलों में प्रतीक तत्व के लैटिन नाम से अक्षर या अक्षरों को लेकर बनाए जाते हैं। Cu तांबा (लैटिन नाम Cuprum), Au सोना (लैटिन नाम Aurum), आदि के लिए।
➢ प्रतीकों का उपयोग करके प्रतिनिधित्व
- प्रतीक एक परमाणु का प्रतिनिधित्व करता है और स्वाभाविक रूप से संबंधित तत्व की एक निश्चित मात्रा को दर्शाता है। हर पदार्थ अपने अणुओं का एक समुच्चय होता है, और पदार्थ के अणु का प्रतीकात्मक प्रतिनिधित्व इसकी सूत्र कहलाता है।
- तत्व के प्रति अणु में परमाणुओं की संख्या को अण्विकता कहा जाता है। यदि किसी तत्व का अणु एक परमाणु содержит करता है, तो अणु केवल प्रतीक से प्रतिनिधित्व किया जाता है, अर्थात इस मामले में प्रतीक भी सूत्र का प्रतिनिधित्व करता है।
- संपर्कता: रासायनिक पदार्थों की संख्या, तत्वों को छोड़कर, इन मूलभूत सामग्रियों के दो या अधिक संयोजनों से मिलकर बनती है।
तत्व की संपर्कता उस तत्व के परमाणु की संयोजन क्षमता होती है और इसे उस संख्या से मापा जाता है जिसमें यह हाइड्रोजन परमाणुओं के साथ संयोजित हो सकता है।
हाइड्रोजन को संदर्भ के मानक के रूप में चुना गया है क्योंकि इसका संयोजक क्षमता सबसे कम है। हालांकि, एक तत्व के परमाणु की संयोजक क्षमता अधिकांशतः स्थिर होती है, लेकिन कुछ तत्व विभिन्न संयोजक क्षमताएँ प्रदर्शित करते हैं। ज्ञात सबसे उच्च संयोजक क्षमता 0 है, और संयोजक क्षमताएँ 0 से लेकर आठ के बीच होती हैं। हीलियम, आर्गन आदि, जिन्हें निष्क्रिय गैसें कहा जाता है, में कोई संयोजक क्षमता नहीं होती है और इसलिए इन्हें शून्य-गुणांक तत्व माना जाता है। संयोजक क्षमता हमेशा एक पूर्णांक होती है। यौगिक भी तत्वों की तरह आणविक सूत्र द्वारा प्रदर्शित किए जाते हैं। एक यौगिक के सूत्र को बनाने के लिए, इसके घटक तत्वों के प्रतीकों को बगल में लिखा जाता है और प्रत्येक के परमाणुओं की संख्या को प्रतीकों के निचले दाएं कोने में अंक डालकर दर्शाया जाता है। लेकिन सूत्र में उप-संकेत एक नहीं लिखा जाता है।
- यौगिक भी तत्वों की तरह आणविक सूत्र द्वारा प्रदर्शित किए जाते हैं। एक यौगिक के सूत्र को बनाने के लिए, इसके घटक तत्वों के प्रतीकों को बगल में लिखा जाता है और प्रत्येक के परमाणुओं की संख्या को प्रतीकों के निचले दाएं कोने में अंक डालकर दर्शाया जाता है। लेकिन सूत्र में उप-संकेत एक नहीं लिखा जाता है।
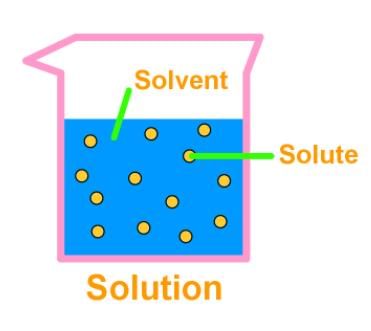
3. समाधान
- एक समाधान दो या अधिक पदार्थों का एक समरूप मिश्रण होता है। समाधान का मुख्य घटक सॉल्वेंट कहलाता है, और छोटा घटक सॉल्यूट कहलाता है। नींबू पानी, सोड़ा पानी आदि सभी समाधान के उदाहरण हैं। हम ठोस समाधान (धातु मिश्र धातु) और गैसीय समाधान (हवा) भी पा सकते हैं।
- समाधान के कण 1 नैनोमीटर (10-9 मीटर) से छोटे होते हैं। इसलिए, इन्हें नग्न आंखों से नहीं देखा जा सकता। सॉल्यूट कण मिश्रण से फिल्ट्रेशन की प्रक्रिया द्वारा अलग नहीं किए जा सकते। सॉल्यूट कण बिना किसी विघटन के सैट नहीं होते, अर्थात, एक समाधान स्थिर होता है।
- समाधान की संकेन्द्रण वह मात्रा है जो प्रति इकाई आयतन या प्रति इकाई द्रव्यमान में उपस्थित सॉल्यूट को दर्शाती है।
- ऐसे पदार्थ जो सॉल्वेंट में अघुलनशील होते हैं और जिनके कण नग्न आंखों से दिखाई देते हैं, वे सस्पेंशन बनाते हैं। एक सस्पेंशन एक विषम मिश्रण है।
4. धातु मिश्र धातु
- धातु मिश्र धातु धातुओं के समरूप मिश्रण होते हैं और इन्हें भौतिक विधियों द्वारा उनके घटकों में अलग नहीं किया जा सकता। फिर भी, एक धातु मिश्र धातु को एक मिश्रण माना जाता है क्योंकि यह अपने घटकों के गुण प्रदर्शित करता है और इसका संघटन परिवर्तनशील हो सकता है। उदाहरण: पीतल लगभग 30% जिंक और 70% कॉपर का मिश्रण है।
- गैर-समरूप प्रणालियाँ, जिनमें ठोस तरल में बिखरे होते हैं, उन्हें सस्पेंशन कहा जाता है। एक सस्पेंशन एक विषम मिश्रण है जिसमें सॉल्यूट कण घुलते नहीं हैं बल्कि माध्यम के पूरे द्रव्यमान में निलंबित रहते हैं।
- कोलॉइड विषम मिश्रण होते हैं जिनमें कणों का आकार नग्न आंखों से देखने के लिए बहुत छोटा होता है, लेकिन यह प्रकाश को फैलाने के लिए बड़ा होता है। कोलॉइड उद्योग और दैनिक जीवन में उपयोगी होते हैं। कणों को विखंडित चरण कहा जाता है और जिस माध्यम में उन्हें वितरित किया जाता है, उसे वितरण माध्यम कहा जाता है।
5. धातु और अधातु
तत्त्वों को सामान्यतः धातुओं, अधातुओं और धातु-लौह तत्वों में विभाजित किया जा सकता है। धातु आमतौर पर निम्नलिखित गुणों में से कुछ या सभी को प्रदर्शित करते हैं:
धातुओं में उच्च पिघलने वाले बिंदु होते हैं। अपवाद: गैलियम और सीज़ियम के पिघलने वाले बिंदु बहुत कम होते हैं।
- धातुएं ऑक्सीजन के साथ मिलकर बेसिक ऑक्साइड बनाती हैं। एल्युमिनियम ऑक्साइड और जस्ता ऑक्साइड दोनों बेसिक और अम्लीय ऑक्साइड के गुण दिखाते हैं। इन ऑक्साइड को अंपोटेरिक ऑक्साइड कहा जाता है।
- धातुओं की विभिन्न प्रतिक्रियाशीलता ऑक्सीजन के प्रति अलग होती है।
- धातुएं पानी और पतले अम्लों के साथ अलग-अलग प्रतिक्रियाएं दिखाती हैं।
- धातुएं प्राकृतिक रूप से स्वतंत्र तत्वों या उनके यौगिकों के रूप में पाई जाती हैं।
- धातुओं का उनके अयस्कों से निकालना और फिर उपयोग के लिए शुद्ध करना धातु विज्ञान कहलाता है।
- कुछ धातुओं, जैसे कि लोहे, की सतह जंग खा जाती है जब उन्हें लंबे समय तक नम वायु के संपर्क में रखा जाता है। इस प्रक्रिया को संक्षारण कहा जाता है।
महत्वपूर्ण बातें:
- धातुओं में चमक होती है। अपवाद: पारा, जो कि एक धातु होते हुए भी तरल है।
- धातुओं का रंग चांदी-ग्रे या सुनहरे पीले होते हैं।
- धातुएं गर्मी और बिजली का संचालक होती हैं। चांदी सबसे अच्छी होती है जबकि तांबा दूसरे स्थान पर होता है।
- धातुएं डक्टाइल (तारों में खींची जा सकती हैं) होती हैं। सोना सबसे अधिक डक्टाइल धातु है।
- धातुएं मैलियाबल (पतली चादरों में पीटी जा सकती हैं) होती हैं। अपवाद: एंटीमोनी और बिस्मथ जैसी धातुएं भंगुर होती हैं।
- धातुएं सोनोरस (हिट होने पर एक रिंगिंग ध्वनि उत्पन्न करती हैं) होती हैं।
- धातुएं सकारात्मक आयन बना सकती हैं, जब वे गैर-धातुओं को इलेक्ट्रॉनों को छोड़ती हैं।
- इलेक्ट्रोलिसिस में, धातुएं नकारात्मक इलेक्ट्रोड (कैथोड) पर जमा होती हैं।
- धातुएं ऑक्सीजन के साथ मिलकर बेसिक ऑक्साइड बनाती हैं।
- धातुओं की ऑक्सीजन के प्रति विभिन्न प्रतिक्रियाएं होती हैं।
- पोटेशियम और सोडियम जैसी धातुएं इतनी तेजी से प्रतिक्रिया करती हैं कि वे खुले में रखे जाने पर आग पकड़ लेती हैं।
- इसलिए, उन्हें कर्नोसिन तेल में डुबोकर रखा जाता है ताकि उन्हें बचाया जा सके और आकस्मिक आग से बचा जा सके।

कार्बनिक रसायन विज्ञान
- कार्बनिक रसायन विज्ञान वह शाखा है जो कार्बन के यौगिकों और हाइड्रोजन (हाइड्रोकार्बन) के अध्ययन से संबंधित है, और उनके व्युत्पन्नों का अध्ययन करती है। वर्तमान में लगभग पांच मिलियन कार्बनिक यौगिक ज्ञात हैं।
- कार्बनिक यौगिक मुख्य रूप से हाइड्रोजन और कार्बन से बने होते हैं। इसलिए, कार्बनिक रसायन विज्ञान को हाइड्रोकार्बन और उनके व्युत्पन्नों का अध्ययन कहा जाता है।
- अधिकतर परमाणु केवल छोटे अणु बनाने में सक्षम होते हैं। हालांकि, एक या दो परमाणु बड़े अणु बना सकते हैं।
- कार्बन बड़े अणु बनाने के लिए सबसे अच्छा परमाणु है। कार्बन ऐसे अणु बना सकता है जिनमें दस, सौ, हजार और यहां तक कि लाखों परमाणु हो सकते हैं! संभावित संयोजनों की विशाल संख्या का अर्थ है कि कार्बन यौगिकों की संख्या सभी अन्य तत्वों के यौगिकों की संख्या से अधिक है!
- एक अकेला कार्बन परमाणु चार अन्य परमाणुओं के साथ संयोजित होने में सक्षम होता है। हम कहते हैं कि इसकी वैलेन्सी 4 है। कभी-कभी एक कार्बन परमाणु कम परमाणुओं के साथ संयोजित होता है।
- कार्बन परमाणु उन कुछ में से एक है जो अपने साथ संयोजित होता है। दूसरे शब्दों में, कार्बन अन्य कार्बन परमाणुओं के साथ संयोजन करता है। इसका अर्थ है कि कार्बन परमाणु श्रृंखलाएँ और रिंग बना सकते हैं जिन पर अन्य परमाणु जुड़े हो सकते हैं। इससे विभिन्न यौगिकों की एक विशाल संख्या उत्पन्न होती है।
- कार्बनिक रसायन विज्ञान मूलतः कार्बन का रसायन विज्ञान है। कार्बन यौगिकों को यह देखते हुए वर्गीकृत किया जाता है कि कार्बन परमाणु कैसे व्यवस्थित हैं और कौन से अन्य परमाणुओं के समूह जुड़े हुए हैं।
➢ हाइड्रोकार्बन
सबसे सरल कार्बनिक यौगिक केवल कार्बन और हाइड्रोजन परमाणुओं से बने होते हैं। यहाँ तक कि इनमें भी हजारों यौगिक होते हैं! केवल कार्बन और हाइड्रोजन के यौगिकों को हाइड्रोकार्बन कहा जाता है।
1. अल्केन
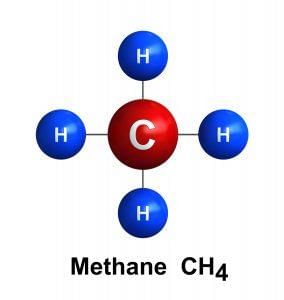
अल्केन में, कार्बन की चार वैलेन्सी बांड विभिन्न परमाणुओं से जुड़े होते हैं। इन प्रकार के बांड को सिंगल बांड कहा जाता है और ये सामान्यतः स्थिर होते हैं तथा अन्य रसायनों द्वारा हमलों के प्रति प्रतिरोधी होते हैं। अल्केन में हाइड्रोजन परमाणुओं की अधिकतम संख्या होती है। इन्हें सैचुरेटेड कहा जाता है। सबसे सरल हाइड्रोकार्बन है:
- मीथेन: CH4, यह हाइड्रोकार्बन श्रृंखला का सबसे सरल सदस्य है। श्रृंखला का प्रत्येक अगला सदस्य पिछले सदस्य की तुलना में एक अधिक कार्बन परमाणु रखता है।
- एथेन: C2H6
- प्रोपेन (हीटिंग फ्यूल): C3H8
- ब्यूटेन (लाइटर / कैंपिंग फ्यूल): C4H10
- पेंटेन: C5H12
- हैक्सेन: C6H14
पॉलीथीन एक बहुत बड़ा अल्केन है जिसमें एक ही अणु में लाखों परमाणु होते हैं। ज्वलनशील होने के अलावा, अल्केन स्थिर यौगिक होते हैं जो भूमिगत पाए जाते हैं।
2. अल्कीन
एक और यौगिकों की श्रृंखला को अल्कीन कहा जाता है। इनका सामान्य सूत्र है: CnH2n। इन यौगिकों का नामकरण अल्केन के समान किया जाता है, सिवाय इसके कि उपसर्ग एक होता है। अल्कीन में अल्केन की तुलना में हाइड्रोजन परमाणुओं की संख्या कम होती है। बचे हुए अतिरिक्त वैलेन्सी एक जोड़ी कार्बन परमाणुओं के बीच डबल बांड के रूप में होती है। डबल बांड सिंगल बांड की तुलना में अधिक प्रतिक्रियाशील होते हैं, जिससे अल्कीन रासायनिक रूप से अधिक प्रतिक्रियाशील होते हैं। सबसे सरल अल्कीन नीचे सूचीबद्ध हैं:
एथिन (औद्योगिक प्रारंभिक रासायनिक): C2H4
- प्रोपीन: C3H6
- ब्यूटीन: C4H8
- पेंटीन: C5H10
- हेक्सीन: C6H12
हेक्सीन का संरचनात्मक सूत्र:
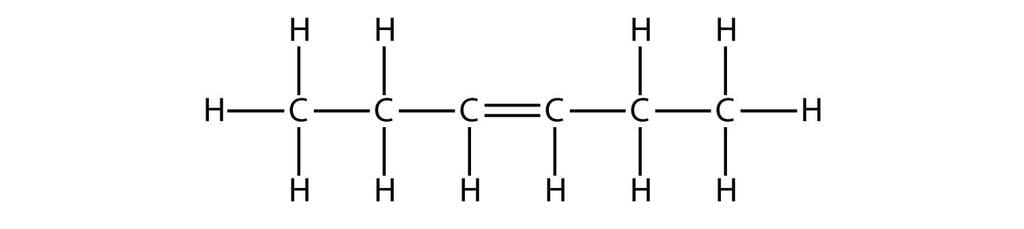
3. अल्काइन
तीसरी श्रृंखला अल्काइन हैं। इनका सूत्र है: CnH2n-2
ये अत्यधिक प्रतिक्रियाशील पदार्थ हैं जिनका कई औद्योगिक उपयोग हैं। इन यौगिकों का नामकरण अल्केन के समान है, केवल भिन्नता यह है कि इसके प्रत्यय -yne है। अल्काइन में दो कार्बन परमाणु एक ट्रिपल बांड द्वारा जुड़े होते हैं। यह अत्यधिक प्रतिक्रियाशील है जिससे ये यौगिक अस्थिर हो जाते हैं। अल्काइन के कुछ उदाहरण हैं:
- एथाइन - जिसे असिटिलीन के नाम से जाना जाता है, जिसका उपयोग पानी के नीचे वेल्डिंग के लिए किया जाता है: C2H2
- प्रोपाइन: C3H4
- ब्यूटाइन: C4H6
- पेंटाइन: C5H8
- हेक्साइन: C6H10
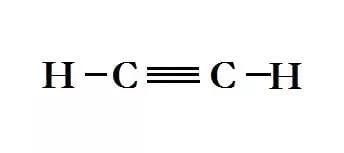
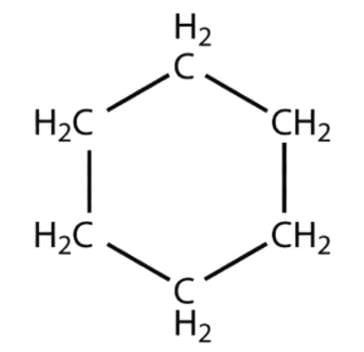
अल्केन, अल्केन और अल्काइन सभी में कार्बन परमाणु रैखिक श्रृंखलाओं में होते हैं। जब रिंगों को श्रृंखलाओं के साथ जोड़ा जाता है, तो हाइड्रोकार्बनों की संख्या लगभग अनंत हो जाती है। कुछ हाइड्रोकार्बन रिंगों में भी व्यवस्थित होते हैं।
कुछ उदाहरण निम्नलिखित हैं:
- साइक्लोहेक्सेन - एक संतृप्त हाइड्रोकार्बन जिसमें परमाणु एक हैक्सागोनल रिंग में व्यवस्थित होते हैं: C6H12
- बेंजीन - एक औद्योगिक सॉल्वेंट। बेंजीन रिंग कार्बनिक रसायन विज्ञान में सबसे महत्वपूर्ण संरचनाओं में से एक है। वास्तव में, इसके वैकल्पिक डबल और सिंगल बांड रिंग के चारों ओर "फैलाए गए" होते हैं ताकि अणु सममित हो सके: C6H6
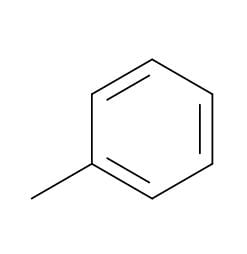
- टोल्यून - एक महत्वपूर्ण सॉल्वेंट और प्रारंभिक रासायनिक: C7H8
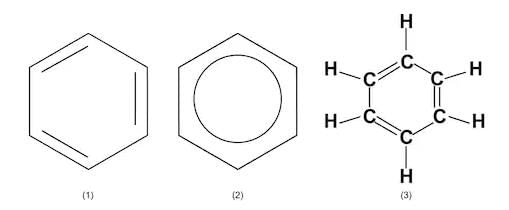
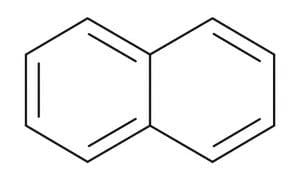
- नैफ्थालीन - जिसका उपयोग मोथबॉल में किया जाता है। इसे दो फ्यूज्ड बेंजीन रिंगों के रूप में चित्रित किया जा सकता है: C10H8
➢ कार्बन, हाइड्रोजन और ऑक्सीजन
जब ऑक्सीजन परमाणु जोड़े जाते हैं, तो यौगिकों की विविधता बहुत बढ़ जाती है। यहां कुछ उदाहरण दिए गए हैं जहां प्रत्येक अणु में एकल कार्यात्मक समूह होता है:
- अल्कोहल्स: अल्कोहल्स में \strong>OH (हाइड्रॉक्सिल) समूह होता है। एक समूह के परमाणु जो एक कार्बनिक श्रृंखला को उसकी विशिष्ट विशेषता देते हैं, उसे कार्यात्मक समूह कहा जाता है। इनका सामान्य सूत्र: CnH2n+1OH। उदाहरण:
- (i) मेथेनॉल (लकड़ी का अल्कोहल) CH3OH
- (ii) एथेनॉल (पीने का अल्कोहल) C2H5OH
- (iii) फेनोल (कार्बोलिक एसिड - जो एक कीटाणुनाशक के रूप में उपयोग होता है) C6H5OH
- ईथर: ईथर में एक \strong>O परमाणु दो हाइड्रोकार्बन श्रृंखलाओं से जुड़ा होता है। इनका सामान्य सूत्र: (CnH2n+1)2O। उदाहरण:
- (i) डाइमिथाइल ईथर (एक गैस) (CH3)2O
- (ii) डाईएथाइल ईथर (एक तरल जो एनेस्थेटिक के रूप में उपयोग होता है) (C2H5)2O
- कीटोन: कीटोन में दो हाइड्रोकार्बन श्रृंखलाओं से जुड़ा \strong>CO समूह होता है। इनका सामान्य सूत्र: (CnH2n+1)2CO। उदाहरण: डाइमिथाइल कीटोन (जिसे एसीटोन भी कहा जाता है: नाखूनों के वार्निश हटाने वाला), CH3COCH3
- एल्डिहाइड्स: एल्डिहाइड्स में हाइड्रोकार्बन श्रृंखला से जुड़ा \strong>CHO समूह होता है। इनका सामान्य सूत्र: CnH2n+1CHO। उदाहरण:
- (i) फॉर्मल्डिहाइड (प्रयोगशालाओं में संरक्षक) - HCHO
- (ii) एसीटाल्डिहाइड - CH3CHO
- फैटी एसिड्स: फैटी एसिड्स में हाइड्रोकार्बन श्रृंखला या रिंग से जुड़ा \strong>CO2H (या COOH) समूह होता है। इनका सामान्य सूत्र: CnH2n+1CO2H। उदाहरण:
- (i) फॉर्मिक एसिड (चींटी के काटने और चिड़चिड़े तीलियों में) - HCO2H
- (ii) एसीटिक एसिड (सिरका) - CH3CO2H
- (iii) ब्यूटिरिक एसिड (बदबूदार मक्खन की गंध) - C2H5CO2H
एक अणु पर दो या अधिक कार्यात्मक समूह होना संभव है। ये समान समूह हो सकते हैं (जैसे ऑक्सालिक एसिड - जो रिवाल्ब पत्तियों में पाया जाने वाला एक विष है - जिसमें दो फैटी एसिड समूह होते हैं) या अलग (जैसे हाइड्रॉक्सीएथेनोइक एसिड - जिसमें एक हाइड्रॉक्सिल समूह और एक फैटी एसिड समूह होता है): ऑक्सालिक एसिड - (COOH)2, हाइड्रॉक्सीएथेनोइक एसिड - CH2OHCOOH।
कार्बन, हाइड्रोजन और ऑक्सीजन युक्त सबसे प्रसिद्ध यौगिक हैं कार्बोहाइड्रेट। एक उदाहरण सामान्य चीनी सुक्रोज (C12H22O11) है।
➢ आइसोमेरिज्म
➢ आइसोमेरिज्म
➢ आइसोमेरिज्म
- कार्बनिक अणुओं से संबंधित एक दिलचस्प घटना को आइसोमेरिज्म कहा जाता है। पहले बताए गए दो यौगिकों पर ध्यान दें। डाइमिथाइल एथर (CH3)2O और एथेनॉल C2H5OH। पहला एक गैस है जो इनहेल करने पर आपको बेहोश कर सकता है। दूसरा एक सामान्य शराब है जो स्पिरिट्स में पी जाती है। दोनों यौगिकों में 2 कार्बन अणु, 6 हाइड्रोजन अणु और 1 ऑक्सीजन अणु होते हैं।
- हालांकि अणु समान हैं, लेकिन इनका व्यवस्थित अलग है। इससे एक समान अणुओं की संख्या के साथ दो अलग-अलग यौगिक उत्पन्न होते हैं। इन यौगिकों को आइसोमर कहा जाता है और इस घटना को आइसोमेरिज्म कहा जाता है। आइसोमेरिज्म कार्बनिक यौगिकों की संख्या को बढ़ाता है। यौगिक में जितने अधिक कार्बन अणु होंगे, अणुओं को व्यवस्थित करने के अधिक तरीके होंगे और आइसोमर्स की संख्या भी बढ़ेगी।
➢ नाइट्रोजन युक्त यौगिक
- नाइट्रोजन जोड़ना: कई महत्वपूर्ण कार्बनिक यौगिकों में नाइट्रोजन होता है। इससे अधिक यौगिकों की श्रृंखला बनती है। (a) एमिन्स (एमिन्स में अमोनिया (NH3) के एक या एक से अधिक हाइड्रोजन अणुओं को एक हाइड्रोकार्बन श्रृंखला या घेरे से प्रतिस्थापित किया जाता है)। इनका सामान्य सूत्र है: CnH2n+1NH2। उदाहरण: (i) मेथिलामिन (एक तीव्र गंध वाला, पानी में घुलनशील गैस)- CH3NH2 (ii) साइनाइड्स (साइनाइड्स में CN समूह होता है) » इनका सामान्य सूत्र है: CnH2n+1CN। उदाहरण: मेथिल साइनाइड- CH3CN (iii) एमिनो एसिड्स (एमिनो एसिड्स में दो कार्यात्मक समूह होते हैं: अमाइन (HN2) समूह और फैटी एसिड (COOH) समूह » इनका सामान्य सूत्र है: CnH2nNH2COOH। उदाहरण: ग्लाइसिन (सबसे सरल एमिनो एसिड)- CH2NH2COOH (iv) एक प्रसिद्ध नाइट्रोजन युक्त यौगिक है ट्रिनिट्रो टोल्यूएन (C6H2CH3(NO)3) - जिसे आमतौर पर TNT के रूप में संक्षिप्त किया जाता है)। यह एक कृत्रिम रूप से निर्मित विस्फोटक है।
आकार में अधिकांश कार्बनिक यौगिकों में कार्बन, हाइड्रोजन, ऑक्सीजन और नाइट्रोजन होता है। अन्य प्रकार के अणुओं को शामिल किया जा सकता है ताकि और भी अधिक यौगिक बनाए जा सकें। इनमें फॉस्फोरस, सल्फर (उदाहरण: थियामिन), क्लोरीन (उदाहरण: क्लोरोफिल- CHCl3, डाइक्लोरो डाइफेनिल ट्राइक्लोरो मीथेन – DDT C14H9Cl15) और आयरन (उदाहरण: हीमोग्लोबिन) शामिल हो सकते हैं।
आवर्तकीय तत्वों का वर्गीकरण
- तत्वों को समान गुणों के आधार पर एक साथ समूहित करना और भिन्न गुणों वाले तत्वों को अलग करना तत्वों का वर्गीकरण कहलाता है। तत्वों को उनके गुणों के आधार पर वर्गीकृत करने वाली तालिका को आवर्त सारणी (Periodic Table) कहा जाता है।
- डोबेराइनर ने तत्वों को त्रैदों में वर्गीकृत किया और न्यूलैंड्स ने अष्टक का नियम (Law of Octaves) दिया। मेंडलीव ने तत्वों को उनके परमाणु द्रव्यमान (Atomic Mass) के बढ़ते क्रम में और उनके रासायनिक गुणों के अनुसार व्यवस्थित किया।
- डोबेराइनर के त्रैदों में तत्वों को परमाणु द्रव्यमान के बढ़ते क्रम में, तीन के समूह में व्यवस्थित किया गया। त्रैद के मध्य तत्व का परमाणु द्रव्यमान अन्य दो तत्वों का अंकगणितीय माध्य (Arithmetic Mean) होता था।
- न्यूलैंड्स का अष्टक का नियम कहता है कि जब तत्वों को उनके परमाणु द्रव्यमान के बढ़ते क्रम में व्यवस्थित किया जाता है, तो आठवां तत्व पहले तत्व के भौतिक और रासायनिक गुणों के समान होता है, जैसे कि संगीत के स्केल में आठवां नोट पहले नोट के समान होता है।
- मेंडलीव का आवर्तीय नियम (Periodic Law) कहता है कि तत्वों के भौतिक और रासायनिक गुण उनके परमाणु द्रव्यमान के आवर्तीय कार्य होते हैं। मेंडलीव ने अपनी आवर्त सारणी में कुछ तत्वों के आधार पर उनके स्थान के अनुसार परमाणु द्रव्यमान को सही किया।
- मेंडलीव ने अपनी आवर्त सारणी में कुछ तत्वों के लिए जो अभी तक खोजे नहीं गए थे, उनके अस्तित्व की भविष्यवाणी की। मेंडलीव की आवर्त सारणी में ऊर्ध्वाधर कॉलम को 'समूह' (Groups) और क्षैतिज पंक्तियों को 'अवधियाँ' (Periods) कहा जाता है।
- आवर्त सारणी विकसित करते समय, कुछ मामलों में मेंडलीव को एक ऐसे तत्व को रखना पड़ा जिसका परमाणु द्रव्यमान थोड़े अधिक था, उससे पहले जिसे थोड़ा कम परमाणु द्रव्यमान था। इस क्रम को उलट दिया गया ताकि समान गुणों वाले तत्वों को एक साथ समूहित किया जा सके।
- मेंडलीव की सारणी हाइड्रोजन या लैंथेनाइड्स और एक्टिनाइड्स तथा आइसोटोप्स को उचित स्थान नहीं दे सकी। सभी तत्वों के आइसोटोप्स मेंडलीव के आवर्तीय नियम के लिए एक चुनौती थे। एक और समस्या यह थी कि परमाणु द्रव्यमान एक तत्व से दूसरे तत्व की ओर बढ़ने पर नियमित तरीके से नहीं बढ़ते। इसलिए यह पूर्वानुमान लगाना संभव नहीं था कि दो तत्वों के बीच कितने तत्व खोजे जा सकते हैं - विशेष रूप से जब हम भारी तत्वों पर विचार करते हैं।
- 1913 में, हेनरी मोस्ली ने दिखाया कि किसी तत्व का परमाणु संख्या (Atomic Number) उसके परमाणु द्रव्यमान से अधिक मौलिक गुण है। इसके अनुसार, मेंडलीव का आवर्तीय नियम संशोधित किया गया और आधुनिक आवर्त सारणी (Modern Periodic Table) और आधुनिक आवर्तीय नियम का आधार परमाणु संख्या को अपनाया गया।
- ऊर्ध्वाधर कॉलम को समूह कहा जाता है, जबकि क्षैतिज पंक्तियों को अवधि कहा जाता है। शाही गैसें तालिका के अत्यंत दाएं हैं और तालिका के अत्यंत बाएं, क्षारीय धातुएं हैं। संक्रमण तत्व (Transition Elements) तालिका के मध्य में B उपसमूहों में रखे जाते हैं। आंतरिक संक्रमण तत्व - लैंथेनाइड्स और एक्टिनाइड्स, आवर्त सारणी के नीचे दो अलग-अलग श्रृंखलाओं में रखे जाते हैं।
- समूह संख्या उस इलेक्ट्रॉनों की संख्या है जो वैलेन्स शेल (Valence Shell) में होती है। समान वैलेन्स संख्या वाले तत्वों को एक साथ समूहित किया जाता है। परमाणु में उपस्थित शेल की संख्या अवधि संख्या देती है।
- परमाणु आकार: परमाणु आकार का अर्थ है एक परमाणु का व्यास (Radius)। परमाणु आकार को एक पृथक परमाणु के नाभिक के केंद्र और बाहरी शेल के बीच की दूरी के रूप में देखा जा सकता है।
|
389 docs|527 tests
|




















