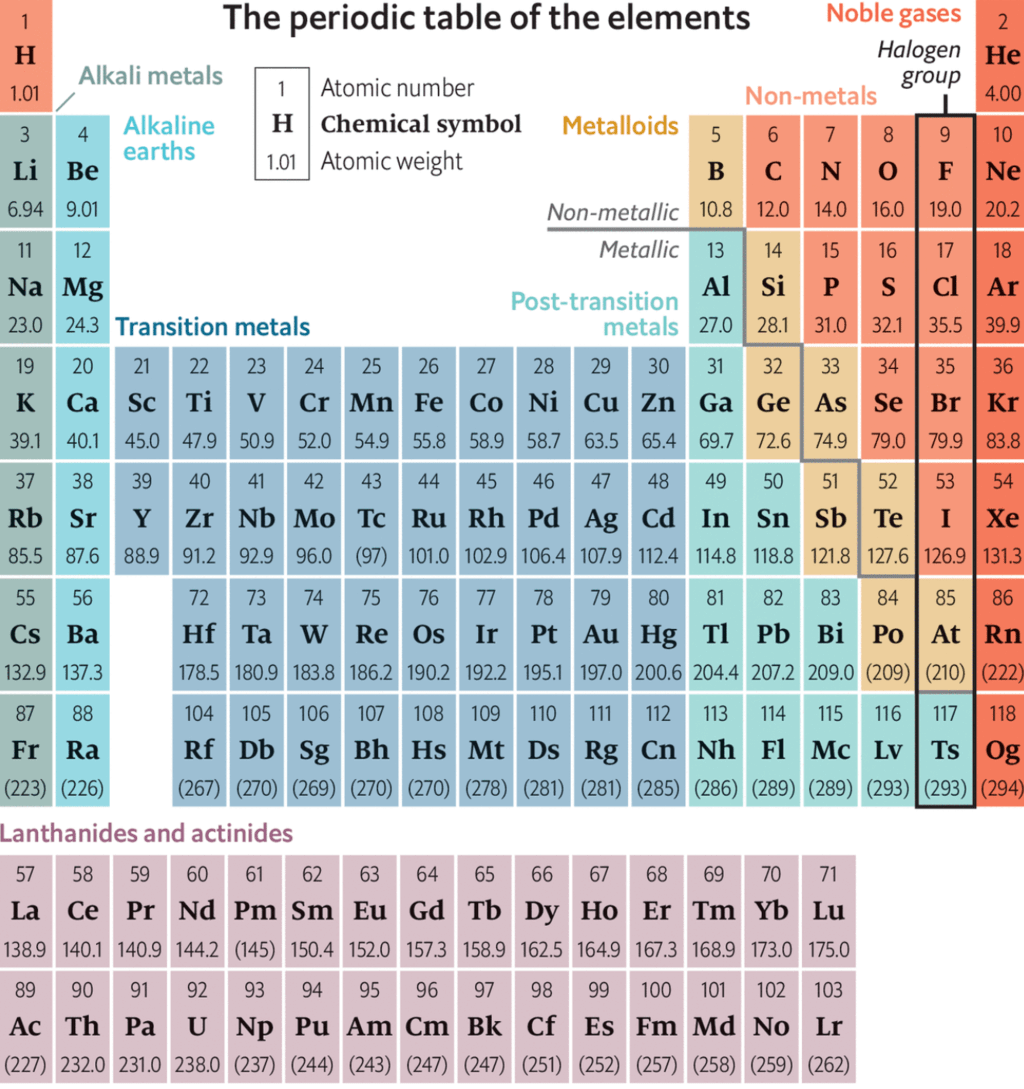
आधुनिक आवर्त कानून और आधुनिक आवर्त तालिका | विज्ञान और प्रौद्योगिकी (Science & Technology) for UPSC CSE PDF Download
मोसेley's आवर्त सारणी
- उन्होंने (1909) 'धातु लक्ष्य' पर इलेक्ट्रॉनों की एक मजबूत किरण द्वारा बमबारी से उत्पन्न एक्स-रे की आवृत्ति का अध्ययन किया।
- उन्होंने पाया कि एक्स-रे की आवृत्ति का वर्गमूल (ν) धातु के प्रभावी नाभिकीय आवेश (z) यानी परमाणु संख्या के सीधे अनुपाती होता है, और यह धातु के परमाणु के परमाणु द्रव्यमान पर निर्भर नहीं होता है।
यानी, ν = a (z - b)
- जहां a अनुपात स्थिरांक है और b किसी दिए गए एक्स-रे श्रृंखला में सभी रेखाओं के लिए एक स्थिरांक है।
- इसलिए, उन्होंने निष्कर्ष निकाला कि परमाणु संख्या किसी तत्व की एक बेहतर मौलिक विशेषता है बजाय इसके परमाणु वजन के।
- उन्होंने सुझाव दिया कि तत्वों की वर्गीकरण का आधार परमाणु वजन के बजाय परमाणु संख्या (z) होनी चाहिए।
आधुनिक आवर्त नियम (मोसेley's आवर्त नियम)
तत्वों की भौतिक और रासायनिक विशेषताएँ उनकी परमाणु संख्या के आवर्त कार्य हैं। यदि तत्वों को उनकी बढ़ती परमाणु संख्या के क्रम में व्यवस्थित किया जाए, तो नियमित अंतराल पर समान विशेषताओं वाले तत्वों की पुनरावृत्ति होती है।
आवर्तिता
जब तत्वों को बढ़ती परमाणु संख्या के क्रम में व्यवस्थित किया जाता है, तो नियमित अंतराल पर तत्वों की विशेषताओं की पुनरावृत्ति को आवर्तिता कहा जाता है।
परिस्थितियों का कारण:
तत्त्वों की गुणों की आवधिक पुनरावृत्ति का कारण यह है कि कुछ नियमित अंतरालों के बाद समान वैलेन्स शेल इलेक्ट्रॉनिक कॉन्फ़िगरेशन का पुनरावृत्ति होती है। उदाहरण के लिए, क्षारीय धातुओं का समान इलेक्ट्रॉनिक कॉन्फ़िगरेशन ns1 है, इसलिए, उनके गुण समान होते हैं।
लंबी रूप की आवधिक तालिका रेंज, वर्नर, बोहर और ब्यूरी का योगदान है।
इस तालिका को बोहर की तालिका भी कहा जाता है क्योंकि यह बोहर की योजना के अनुसार तत्वों को चार प्रकारों में वर्गीकृत करती है जो कि तत्वों के इलेक्ट्रॉनिक कॉन्फ़िगरेशन पर आधारित है।
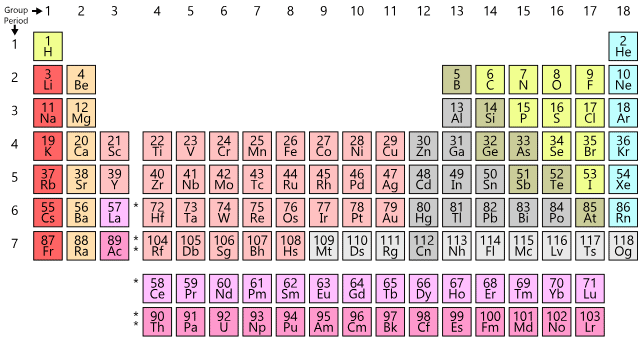
आधुनिक आवधिक तालिका क्षैतिज पंक्तियों (अवधियाँ) और ऊर्ध्वाधर कॉलम (समूह) से मिलकर बनी है।
अवधियाँ:
कुल सात अवधियाँ हैं जिन्हें 1, 2, 3, 4, 5, 6 और 7 के रूप में क्रमांकित किया गया है।
- (i) प्रत्येक अवधि में समान वैलेन्स शेल वाले तत्वों की एक श्रृंखला होती है।
- (ii) प्रत्येक अवधि एक विशेष प्रधान क्वांटम संख्या के वैलेन्स शेल से संबंधित होती है।
- (iii) प्रत्येक अवधि एक क्षारीय धातु के साथ शुरू होती है, जिसमें बाहरी इलेक्ट्रॉनिक कॉन्फ़िगरेशन ns1 होता है।
- (iv) प्रत्येक अवधि एक उदात्त गैस के साथ समाप्त होती है, जिसमें बाहरी इलेक्ट्रॉनिक कॉन्फ़िगरेशन ns2np6 होता है, सिवाय हीलियम के, जिसमें बाहरी इलेक्ट्रॉनिक कॉन्फ़िगरेशन 1s2 होता है।
- (v) प्रत्येक अवधि नए ऊर्जा स्तर के भरने के साथ शुरू होती है।
- (vi) प्रत्येक अवधि में तत्वों की संख्या उस ऊर्जा स्तर में उपलब्ध परमाणु कक्षों की संख्या का दो गुना होती है, जो भरा जा रहा है। उदाहरण के लिए:
1st अवधि सबसे छोटी अवधि है जिसमें केवल दो तत्व होते हैं। इलेक्ट्रॉन का भरना पहले ऊर्जा शेल में होता है, जिसके लिए,
n = 1, l = 0 (s- उपशेल) और m = 0।
केवल एक ऑर्बिटल (1s) उपलब्ध है और इस प्रकार इसमें केवल दो तत्व होते हैं। 3rd पीरियड छोटा पीरियड है जिसमें केवल आठ तत्व होते हैं। इलेक्ट्रॉनों की भराई तीसरे ऊर्जा स्तर में होती है। जिसके लिए,
n = 3, l = 0, 1, 2 और ऑर्बिटल की संख्या m = 0, 3, 5
ऑर्बिटल की संख्या 1 3 5
(3s) (3p) (3d)
कुल ऑर्बिटल की संख्या 9 है।
लेकिन 3d ऑर्बिटल की ऊर्जा 4s ऑर्बिटल से अधिक होती है। इसलिए, चार ऑर्बिटल (एक 3s और तीन 3p ऑर्बिटल) जो n = 3 के अनुरूप हैं, 4s ऑर्बिटल (अगले ऊर्जा स्तर) में भरने से पहले भरे जाते हैं। इसलिए 3rd पीरियड में आठ तत्व होते हैं, न कि अठारह तत्व।
ग्रुप्स:
कुल अठारह समूह हैं जिन्हें 1, 2, 3, 4, 5, ................ 13, 14, 15, 16, 17, 18 के रूप में क्रमांकित किया गया है।
एक समूह में समान वैलेंस शेल इलेक्ट्रॉनिक कॉन्फ़िगरेशन वाले तत्वों की श्रृंखला होती है।
पिरियडिक प्रॉपर्टीज़
हीलियम s-ब्लॉक में आता है क्योंकि अंतिम प्रविष्ट इलेक्ट्रॉन s-ब्लॉक में जाता है।
- इरीडियम सबसे घना तत्व है इसके बाद ऑस्मियम आता है।
- (1) अंतिम प्रविष्ट इलेक्ट्रॉन (आउफबॉ के सिद्धांत के अनुसार) तत्व के ब्लॉक का निर्धारण करता है।
- (2) वैलेंस शेल पीरियड नंबर को निर्धारित करता है।
पिरियडिक टेबल की सामान्य विशेषताएँ
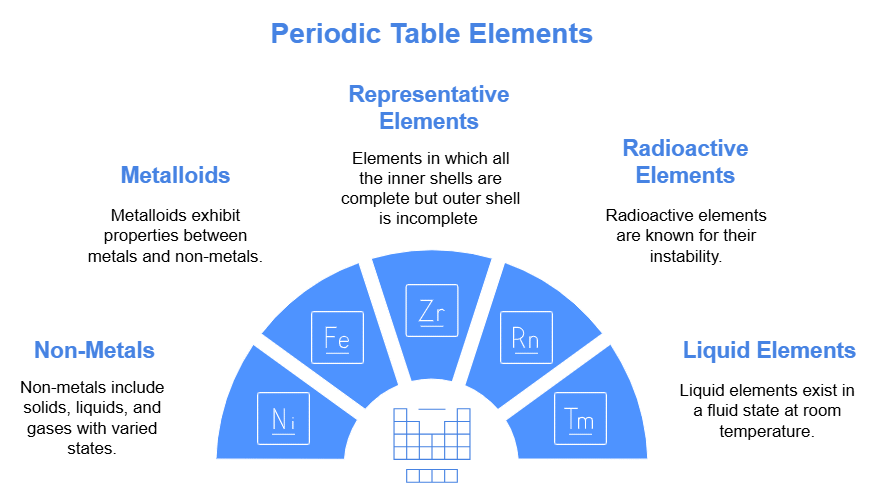
(1) पिरियडिक टेबल में सत्रह गैर-धातु (हाइड्रोजन सहित) हैं।
(2) पांच गैर-धातु ठोस हैं: C, P, S, Se, I
(3) एक गैर-धातु तरल है, अर्थात् Br
(4) ग्यारह गैर-धातु गैसों के रूप में मौजूद हैं।
(5) छह गैसें मोनोएटॉमिक (आरामदायक गैसें) हैं, अर्थात् He, Ne, Ar, Kr, Xe, Rn।
(6) पाँच गैसें डायटॉमिक हैं, जो H, F, N, O, Cl हैं।
(7) आवर्त सारणी में आठ मेटालॉइड्स होते हैं, जैसे B, Si, Ge, As, Sb, Te, Po, At।
(8) पाँच तत्व कमरे के तापमान पर तरल होते हैं, अर्थात् Cs, Fr, Ga, Hg, और Br।
(9) s - ब्लॉक और p - ब्लॉक को मिलाकर प्रतिनिधि तत्व कहा जाता है।
(10) प्रतिनिधि तत्वों में पाँच तत्व रेडियोधर्मी होते हैं। ये हैं Po, At, Rn, Fr और Ra।
(11) लंबे रूप की आवर्त सारणी में सात पीरियड्स होते हैं।
|
1 videos|326 docs|212 tests
|




















