एनसीईआरटी सारांश: अम्ल, क्षार और नमक | विज्ञान और प्रौद्योगिकी (Science & Technology) for UPSC CSE PDF Download
कल्पना करें कि आप एक स्वादिष्ट भोजन का आनंद ले रहे हैं, लेकिन बाद में आपको अपने पेट में एसिडिटी का वह परिचित जलन महसूस होती है। आप किस चीज़ के लिए पहुँचते हैं—नींबू का रस, सिरका, या बेकिंग सोडा का घोल? आपकी माँ शायद अतिरिक्त एसिड को संतुलित करने के लिए बेकिंग सोडा के घोल का सुझाव देती हैं, लेकिन आप जानना चाहते हैं कि ऐसा क्यों? इस अध्याय में हम एसिड, बेस और नमक के बीच विभिन्न प्रतिक्रियाओं के बारे में पढ़ेंगे।
सोचिए कि जब आपने पिछले बार एक सफेद शर्ट पर करी गिराई थी। क्या आपने देखा कि जब आप इसे साबुन से रगड़ते हैं तो दाग लाल-भूरा हो जाता है? इसका कारण यह है कि साबुन बुनियादी (basic) है, और यह करी में हल्दी के साथ प्रतिक्रिया करता है। फिर, जब आप इसे पानी से धोते हैं, तो दाग फिर से पीला हो जाता है।
आपने सीखा है कि एसिड खट्टे होते हैं, जैसे नींबू का रस, जबकि बेस कड़वे होते हैं। लेकिन हम उन्हें बिना चखे कैसे पहचान सकते हैं? संकेतक हमें एसिड और बेस की पहचान करने में मदद करते हैं। इस अध्याय में, हम देखेंगे कि एसिड और बेस एक-दूसरे के साथ कैसे प्रतिक्रिया करते हैं, और रोज़मर्रा के उदाहरणों का अन्वेषण करेंगे जो उनकी दिलचस्प रसायन विज्ञान को प्रदर्शित करते हैं।
एसिड और बेस के रासायनिक गुणों को समझना
(a) प्रयोगशाला में एसिड और बेस
चलो पहले एसिड और बेस के मूल सिद्धांत को समझते हैं।
एसिड क्या है?
यह एक रासायनिक यौगिक है जो एक विशिष्ट खट्टा स्वाद रखता है और एसिडिक होने की विशेषता रखता है। रासायनिक रूप से, यह 7 से कम pH मूल्य द्वारा परिभाषित किया जाता है, जो दर्शाता है कि इसमें हाइड्रोजन आयनों की तुलना में हाइड्रॉक्साइड आयनों की अधिक सांद्रता होती है।
- मजबूत एसिड: एक एसिड जो पानी में पूरी तरह से या लगभग पूरी तरह से अस्थिर हो जाता है, उसे मजबूत एसिड कहते हैं। उदाहरण: HCl, H2SO4, और HNO3। इन्हें अकार्बनिक एसिड भी कहा जाता है, सिवाय कार्बोनिक एसिड (H2CO3) के, जो वास्तव में एक कमजोर एसिड है लेकिन अकार्बनिक है।
- कमजोर एसिड: वह एसिड जो पानी में केवल आंशिक रूप से अस्थिर होता है। उदाहरण: CH3COOH, ऑक्सालिक एसिड, और लैक्टिक एसिड। इन्हें कार्बनिक एसिड कहा जाता है।
- सघन एसिड: एक सघन घोल वह तरल होता है जिसमें उच्च घोलन सांद्रता होती है। एक पतला एसिड वह तरल होता है जिसमें कम घोलन सांद्रता होती है। उदाहरण: Conc. H2SO4 और Conc. HCl।
- पतला एसिड: एक पतला घोल वह तरल होता है जिसमें कम घोलन सामग्री होती है। उदाहरण: H2SO4 की 5% सांद्रता को एक पतला एसिड माना जाता है।
बेस क्या है?
एक रासायनिक यौगिक जो एक विशिष्ट कड़वा स्वाद रखता है और बुनियादी होने की विशेषता रखता है, उसे बेस कहा जाता है। रासायनिक रूप से, इसे 7 से अधिक pH मूल्य द्वारा परिभाषित किया जाता है, जो दर्शाता है कि इसमें हाइड्रॉक्साइड आयनों की अधिक सांद्रता होती है।
- मजबूत बेस: वे बेस जो पानी में पूरी तरह से आयनित होते हैं और बड़ी संख्या में हाइड्रॉक्साइड आयन उत्पन्न करते हैं। उदाहरण: NaOH, KOH, Ca(OH)2।
- कमजोर बेस: वे बेस जो पानी में आंशिक रूप से आयनित होते हैं और थोड़े हाइड्रॉक्साइड आयन उत्पन्न करते हैं। उदाहरण: NH4OH।
- अल्कलाइज़: ये बेस हैं जो पानी में घुलनशील होते हैं। उदाहरण: NaOH, KOH, Ca(OH)2।
संकेतक के माध्यम से एसिड और बेस को पहचानना
एक संकेतक एक रासायनिक यौगिक है जो एसिड या बेस की उपस्थिति में अपना रंग बदलता है। संकेतक सामान्यतः पौधों के रंगद्रव से प्राप्त होते हैं और इनमें हल्की एसिडिक या बुनियादी विशेषताएँ होती हैं।
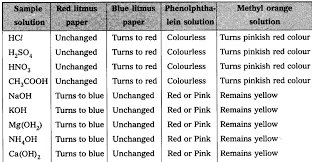
गतिविधि 1: प्रयोगशाला के घोलों का परीक्षण संकेतकों के साथ
- सामग्री: हाइड्रोक्लोरिक एसिड (HCl), सल्फ्यूरिक एसिड (H₂SO₄), नाइट्रिक एसिड (HNO₃), एसीटिक एसिड (CH₃COOH), सोडियम हाइड्रॉक्साइड (NaOH), कैल्शियम हाइड्रॉक्साइड (Ca(OH)₂), पोटेशियम हाइड्रॉक्साइड (KOH), मैग्नीशियम हाइड्रॉक्साइड (Mg(OH)₂), अमोनियम हाइड्रॉक्साइड (NH₄OH), लाल और नीला लिटमस पेपर, फिनोफ्थेलीन, मिथाइल ऑरेंज।
- प्रक्रिया: प्रत्येक घोल की एक बूँद एक घड़ी के कांच पर डालें और लाल और नीले लिटमस पेपर, फिनोफ्थेलीन, और मिथाइल ऑरेंज के साथ परीक्षण करें।
- अवलोकन: प्रत्येक घोल के लिए प्रत्येक संकेतक के साथ रंग परिवर्तन का रिकॉर्ड करें ताकि उनकी एसिडिक या बुनियादी प्रकृति की पहचान की जा सके।
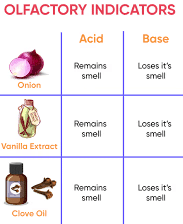
गतिविधि 2: सुगंधित संकेतकों का परीक्षण
- सामग्री: बारीक कटे हुए प्याज, एक प्लास्टिक बैग, साफ कपड़े के स्ट्रिप्स, पतला HCl, पतला NaOH, वनीला सुगंध, लौंग का तेल।
- प्रक्रिया: कटे हुए प्याज और कपड़े के स्ट्रिप्स को एक प्लास्टिक बैग में डालें, इसे सील करें, और रात भर फ्रिज में छोड़ दें।
- एक दिन बाद, कपड़े के स्ट्रिप्स को निकालें, उनकी गंध की जाँच करें। फिर, एक स्ट्रिप पर कुछ बूँदें पतले HCl की डालें और दूसरी पर पतला NaOH। दोनों स्ट्रिप्स को पानी से धोएं और गंध में किसी भी परिवर्तन को नोट करें। वनीला सुगंध और लौंग के तेल की गंध का परीक्षण करें, फिर किसी भी परिवर्तन को देखें।
- परिणाम: यह निर्धारित करें कि कौन से पदार्थ (प्याज, वनीला सुगंध, लौंग का तेल) उनके गंध परिवर्तनों के आधार पर प्रभावी सुगंधित संकेतक के रूप में कार्य करते हैं।
हमने सीखा है कि संकेतकों के साथ एसिड और बेस की पहचान कैसे की जाती है, अब हम उनके गुणों और प्रतिक्रियाओं के बारे में जानेंगे।
(b) एसिड और बेस कैसे धातुओं के साथ प्रतिक्रिया करते हैं?
सामान्यतः, एसिड धातुओं के साथ प्रतिक्रिया करते हैं जिससे नमक बनता है और हाइड्रोजन गैस मुक्त होती है। बेस आमतौर पर धातुओं के साथ प्रतिक्रिया नहीं करते हैं, लेकिन कुछ धातुएं बेस के साथ प्रतिक्रिया कर सकती हैं और नमक और हाइड्रोजन गैस उत्पन्न कर सकती हैं। इसका कारण यह है कि धातुएं और बेस दोनों इलेक्ट्रॉनों को छोड़ने की प्रवृत्ति रखते हैं, और यदि दोनों ऐसा करते हैं, तो इलेक्ट्रॉनों के लिए कोई पसंदीदा दिशा नहीं होती है, इसलिए कोई प्रतिक्रिया नहीं होती है। हालाँकि, कुछ धातुएं, जैसे जस्ता, एम्फोटेरिक होती हैं और एसिड और बेस दोनों के साथ प्रतिक्रिया कर सकती हैं। उदाहरण के लिए, जब सोडियम हाइड्रॉक्साइड का घोल जिंक के साथ गर्म किया जाता है, तो यह सोडियम जिंकाट और हाइड्रोजन गैस बनाता है।
एसिड के साथ धातुओं की प्रतिक्रिया
जब एक एसिड एक धातु के साथ प्रतिक्रिया करता है, तो धातु एक विस्थापन प्रतिक्रिया पर होती है, जिसमें वह एसिड से हाइड्रोजन को विस्थापित करती है। इसका परिणाम नमक और हाइड्रोजन गैस के निर्माण में होता है।
- प्रतिक्रिया के समीकरण: एसिड धातु → नमक हाइड्रोजन गैस। उदाहरण: जिंक के ग्रेन्यूल्स पतला हाइड्रोक्लोरिक एसिड के साथ प्रतिक्रिया करते हैं। HCl + Zn → ZnCl2 + H2↑
धातुओं के साथ बेस की प्रतिक्रिया
धातु के साथ बेस की प्रतिक्रिया से हाइड्रोजन गैस उत्पन्न होती है। ध्यान दें कि सभी धातुएं बेस के साथ प्रतिक्रिया नहीं करती हैं। धातु को बेस में मौजूद धातुओं की तुलना में अधिक प्रतिक्रियाशील होना आवश्यक है ताकि प्रतिक्रिया हो सके।
- प्रतिक्रिया के समीकरण: बेस धातु → नमक हाइड्रोजन गैस। उदाहरण: जिंक के ग्रेन्यूल्स NaOH के घोल के साथ प्रतिक्रिया करते हैं और सोडियम जिंकाट उत्पन्न करते हैं और हाइड्रोजन गैस मुक्त होती है। 2NaOH + Zn → Na2ZnO2 + H2↑
नोट: मुक्त हुई हाइड्रोजन गैस का परीक्षण जलती हुई मोमबत्ती को गैस के बुलबुले के पास लाकर किया जा सकता है, यह पॉप ध्वनि के साथ फट जाती है।
(c) धातु कार्बोनेट और धातु हाइड्रोजन कार्बोनेट एसिड के साथ कैसे प्रतिक्रिया करते हैं?
एसिड धातु कार्बोनेट और धातु हाइड्रोजन कार्बोनेट के साथ प्रतिक्रिया करते हैं जिससे नमक, कार्बन डाइऑक्साइड और पानी उत्पन्न होता है।
- प्रतिक्रिया: धातु कार्बोनेट/धातु हाइड्रोजन कार्बोनेट + एसिड → नमक + कार्बन डाइऑक्साइड + पानी। उदाहरण:
- (i) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O
- (ii) HCl + NaHCO3 → NaCl + CO2 + H2O
CO2 का परीक्षण चूने के पानी के माध्यम से किया जा सकता है। यह चूने के पानी को दूधिया बना देता है। Ca(OH)2 + CO2 → CaCO3 + H2O
जब अतिरिक्त CO2 डाला जाता है, तो दूधियत गायब हो जाती है। CaCO3 + CO2 + H2O → Ca(HCO3)2 (aq)
चूना पत्थर, चाक और संगमरमर कैल्शियम कार्बोनेट के विभिन्न रूप हैं। सभी धातु कार्बोनेट और हाइड्रोजन कार्बोनेट एसिड के साथ प्रतिक्रिया करते हैं जिससे एक संबंधित नमक, कार्बन डाइऑक्साइड और पानी प्राप्त होता है। इस प्रकार, प्रतिक्रिया को इस प्रकार संक्षिप्त किया जा सकता है:
- धातु कार्बोनेट/धातु हाइड्रोजन कार्बोनेट + एसिड → नमक + कार्बन डाइऑक्साइड + पानी
बेस धातु कार्बोनेट और धातु हाइड्रोजन कार्बोनेट के साथ प्रतिक्रिया नहीं करते हैं।
(d) एसिड और बेस एक-दूसरे के साथ कैसे प्रतिक्रिया करते हैं?
एसिड और बेस के बीच की प्रतिक्रिया को न्यूट्रलाइजेशन प्रतिक्रिया के रूप में जाना जाता है। जब एक एसिड और एक बेस एक साथ मिलते हैं, तो वे नमक और पानी का निर्माण करते हैं।
- प्रतिक्रियाएँ: एसिड और बेस मिलकर नमक और पानी उत्पन्न करते हैं। एसिड + बेस → नमक + H2O
- न्यूट्रलाइजेशन प्रतिक्रिया: एसिड और बेस की प्रतिक्रिया को न्यूट्रलाइजेशन प्रतिक्रिया कहा जाता है। उदाहरण: HCl + NaOH → NaCl + H2O
कुछ और प्रतिक्रियाएँ:
- 1. मजबूत एसिड + कमजोर बेस → एसिडिक नमक + H2O
- उदाहरण: HCl + NH3 → NH4Cl + H2O (हाइड्रोक्लोरिक एसिड + अमोनिया → अमोनियम क्लोराइड + पानी)
- 2. कमजोर एसिड + मजबूत बेस → बुनियादी नमक + H2O
- उदाहरण: CH3COOH + NaOH → CH3COONa + H2O (एसीटिक एसिड + सोडियम हाइड्रॉक्साइड → सोडियम एसीटेट + पानी)
- 3. मजबूत एसिड + मजबूत बेस → न्यूट्रल नमक + H2O
- उदाहरण: H2SO4 + 2NaOH → Na2SO4 + 2H2O (सल्फ्यूरिक एसिड + सोडियम हाइड्रॉक्साइड → सोडियम सल्फेट + पानी)
- 4. कमजोर एसिड + कमजोर बेस → न्यूट्रल नमक + H2O
- उदाहरण: CH3COOH + NH3 → CH3COONH4 + H2O (एसीटिक एसिड + अमोनिया → अमोनियम एसीटेट + पानी)
नोट: परिणामी घोल का pH उस एसिड और बेस की ताकत पर निर्भर करता है जो उपयोग किए गए हैं। यदि एसिड मजबूत है और बेस कमजोर है, तो परिणामी घोल एसिडिक होगा। यदि बेस मजबूत है और एसिड कमजोर है, तो परिणामी घोल बुनियादी होगा। यदि दोनों एसिड और बेस समान रूप से मजबूत या कमजोर हैं, तो परिणामी घोल न्यूट्रल होगा।
(e) धातु ऑक्साइड के साथ एसिड की प्रतिक्रिया
(i) धातु ऑक्साइड के साथ एसिड की प्रतिक्रिया
जब एक धातु ऑक्साइड एक एसिड के साथ प्रतिक्रिया करता है, तो यह सामान्यतः नमक और पानी उत्पन्न करता है। इस प्रकार की प्रतिक्रिया का सामान्य रासायनिक समीकरण है:
- धातु ऑक्साइड + एसिड → नमक + पानी
उदाहरण: जब कैल्शियम ऑक्साइड (CaO) हाइड्रोक्लोरिक एसिड (HCl) के साथ प्रतिक्रिया करता है, तो यह कैल्शियम क्लोराइड (CaCl2) और पानी (H2O) उत्पन्न करता है:
- CaO + 2HCl → CaCl2 + H2O
चूंकि धातु ऑक्साइड एसिड के साथ प्रतिक्रिया करके नमक और पानी उत्पन्न करते हैं, बेस के साथ एसिड की प्रतिक्रिया के समान, धातु ऑक्साइड मुख्य रूप से बुनियादी ऑक्साइड होते हैं, लेकिन कुछ एम्फोटेरिक गुण भी प्रदर्शित कर सकते हैं।
(f) गैर-धातु ऑक्साइड के साथ बेस की प्रतिक्रिया
गैर-धातु ऑक्साइड एसिडिक होते हैं और बेस के साथ प्रतिक्रिया करते हैं जिससे नमक और पानी बनते हैं। गैर-धातु ऑक्साइड और बेस के बीच प्रतिक्रिया का सामान्य रासायनिक समीकरण है:
- गैर-धातु ऑक्साइड + बेस → नमक + पानी
गंधक डाइऑक्साइड (SO2) और सोडियम हाइड्रॉक्साइड (NaOH) के बीच प्रतिक्रिया:
- SO2 + 2NaOH → Na2SO3 + H2O
गैर-धातु ऑक्साइड स्वाभाविक रूप से एसिडिक होते हैं।
एसिड और बेस के कुछ सामान्य प्रतिक्रियाएँ:
- (i) एसिड + धातु कार्बोनेट → नमक + CO2 + पानी
- (ii) एसिड + धातु → नमक + H2
- (iii) एसिड + धातु ह
आपने सीखा कि अम्ल खट्टे होते हैं, जैसे नींबू का रस, जबकि क्षार कड़वे होते हैं। लेकिन हम उन्हें बिना चखे कैसे पहचान सकते हैं? सूचक हमें अम्ल और क्षार की पहचान करने में मदद करते हैं। इस अध्याय में, हम यह जानेंगे कि अम्ल और क्षार एक-दूसरे के साथ कैसे प्रतिक्रिया करते हैं और ऐसे रोजमर्रा के उदाहरणों का अन्वेषण करेंगे जो उनकी आकर्षक रसायन विज्ञान को प्रदर्शित करते हैं।
अम्ल क्या है?
अम्ल क्या है?
(i) मजबूत अम्ल: वह अम्ल जो पानी में पूरी तरह से या लगभग पूरी तरह से विघटित होते हैं, उन्हें मजबूत अम्ल कहा जाता है। उदाहरण: HCl, H2SO4, और HNO3। इन्हें अकार्बनिक अम्ल भी कहा जाता है, सिवाय कार्बोनिक अम्ल (H2CO3) के, जो वास्तव में एक कमजोर अम्ल है लेकिन अकार्बनिक है।
(ii) कमजोर अम्ल: वह अम्ल जो पानी में घुलने पर केवल आंशिक रूप से विघटित होते हैं, उन्हें कमजोर अम्ल कहा जाता है। उदाहरण: CH3COOH, ऑक्सालिक अम्ल, और लैक्टिक अम्ल। इन्हें कार्बनिक अम्ल भी कहा जाता है।
(iii) घनत्व वाले अम्ल: एक घनत्व वाला विलयन वह तरल होता है जिसमें उच्च घुलनशीलता होती है। एक पतला अम्ल उस तरल के रूप में परिभाषित किया जाता है जिसमें कम घुलनशीलता होती है, जबकि एक घनत्व वाला अम्ल में उच्च घुलनशीलता होती है। (अम्ल की अधिक मात्रा, पानी की कम मात्रा)। उदाहरण: Conc. H2SO4 और Conc. HCl।
(iv) पतले अम्ल: एक पतला विलयन वह तरल होता है जिसमें कम घुलनशीलता होती है। (पानी की अधिक मात्रा, अम्ल की कम मात्रा)। उदाहरण: H2SO4 जिसकी 5% सांद्रता है, उसे पतला अम्ल माना जाता है।
क्षार की श्रेणियाँ
क्षार की श्रेणियाँ
(i) मजबूत क्षार: मजबूत क्षार वे होते हैं जो पानी में पूरी तरह से आयनित होते हैं और बड़ी संख्या में हाइड्रॉक्साइड आयन उत्पन्न करते हैं। कमजोर क्षार वे होते हैं जो पानी में आंशिक रूप से आयनित होते हैं और कम संख्या में हाइड्रॉक्साइड आयन उत्पन्न करते हैं। उदाहरण: NaOH, KOH, Ca(OH)2।

(ii) कमजोर आधार: कमजोर आधार वे होते हैं जो पानी में आंशिक रूप से आयनित होते हैं और थोड़ी मात्रा में हाइड्रॉक्साइड आयन उत्पन्न करते हैं। उदाहरण: NH4OH
(iii) क्षार: ये वे आधार हैं जो पानी में घुलनशील होते हैं। उदाहरण: NaOH, KOH, Ca(OH)2।
अब हम संकेतक की मदद से अम्ल और आधार में अंतर कैसे करें, यह समझते हैं। एक संकेतक एक रासायनिक यौगिक है जो अम्ल या आधार की उपस्थिति में अपना रंग बदलता है। संकेतक आमतौर पर पौधों के रंगद्रव से निकाले जाते हैं और ये हल्के अम्लीय या क्षारीय स्वभाव के होते हैं।
(i) अम्लों का धातुओं के साथ अभिक्रिया: जब एक अम्ल एक धातु के साथ अभिक्रिया करता है, तो धातु एक विस्थापन अभिक्रिया में जाती है, जहाँ यह अम्ल से हाइड्रोजन को विस्थापित करती है। इससे एक नमक और हाइड्रोजन गैस उत्पन्न होती है।
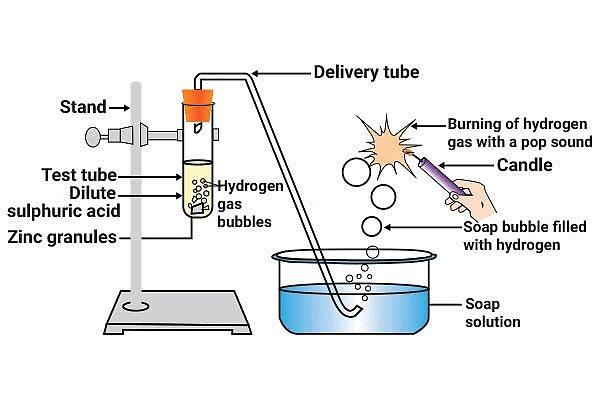
समिकरण: अम्ल + धातु → नमक + हाइड्रोजन गैस
उदाहरण: जस्ते की ग्रेन्यूल्स पतले हाइड्रोक्लोरिक अम्ल के साथ टेस्ट ट्यूब में अभिक्रिया करते हैं। HCl + Zn → ZnCl2 + H2↑
समिकरण: आधार + धातु → नमक + हाइड्रोजन गैस
उदाहरण: जस्ते की ग्रेन्यूल्स NaOH घोल के साथ अभिक्रिया करके सोडियम जिंकैट बनाते हैं और हाइड्रोजन गैस उत्पन्न करते हैं। 2NaOH + Zn → Na2ZnO2 + H2↑

- अम्ल धातु कार्बोनेट्स और धातु हाइड्रोजन कार्बोनेट्स के साथ अभिक्रिया करके नमक, कार्बन डाइऑक्साइड और पानी बनाते हैं।
- अभिक्रिया: धातु कार्बोनेट/धातु हाइड्रोजन कार्बोनेट + अम्ल → नमक + कार्बन डाइऑक्साइड + पानी।
- उदाहरण:
- (i) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O
- (ii) HCl + NaHCO3 → NaCl + CO2 + H2O
- CO2 को चूना पानी के माध्यम से गुजारकर परीक्षण किया जा सकता है। यह चूना पानी को दूधिया बना देता है। Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 - चूना पानी
CaCO3 - सफेद अवक्षिप्त
जब अतिरिक्त CO2 पास किया जाता है, तो दूधापन गायब हो जाता है। CaCO3 + CO2 + H2O → Ca(HCO3)2 (aq)
- जब अतिरिक्त CO2 पास किया जाता है, तो दूधापन गायब हो जाता है। CaCO3 + CO2 + H2O → Ca(HCO3)2 (aq)
धातु कार्बोनेट/धातु हाइड्रोजन कार्बोनेट + अम्ल → नमक + कार्बन डाइऑक्साइड + पानी
- अवसादी धातु कार्बोनेट और धातु हाइड्रोजन कार्बोनेट के साथ आधार प्रतिक्रिया नहीं करते हैं। आधार + धातु कार्बोनेट/धातु हाइड्रोजन कार्बोनेट → कोई प्रतिक्रिया नहीं
- अम्ल और आधार नमक और पानी बनाने के लिए प्रतिक्रिया करते हैं। अम्ल + आधार → नमक + H2O
- न्यूट्रलाइजेशन प्रतिक्रिया: अम्ल और आधार की प्रतिक्रिया को न्यूट्रलाइजेशन प्रतिक्रिया कहा जाता है। उदाहरण: HCl + NaOH → NaCl + H2O
1. मजबूत अम्ल + कमजोर आधार → अम्लीय नमक + H2O
उदाहरण: HCl + NH3 → NH4Cl + H2O (हाइड्रोक्लोरिक अम्ल + अमोनिया → अमोनियम क्लोराइड + पानी)
2. कमजोर अम्ल + मजबूत आधार → आधारीय नमक + H2O
उदाहरण: CH3COOH + NaOH → CH3COONa + H2O (असिटिक अम्ल + सोडियम हाइड्रॉक्साइड → सोडियम एसीटेट + पानी)
3. मजबूत अम्ल + मजबूत आधार → न्यूट्रल नमक + H2O
उदाहरण: H2SO4 + 2NaOH → Na2SO4 + 2H2O (सल्फ्यूरिक अम्ल + सोडियम हाइड्रॉक्साइड → सोडियम सल्फेट + पानी)
4. कमजोर अम्ल + कमजोर आधार → न्यूट्रल नमक + H2O
उदाहरण: CH3COOH + NH3 → CH3COONH4 + H2O (असिटिक अम्ल + अमोनिया → अमोनियम एसीटेट + पानी)
निष्कर्षित समाधान का pH उस अम्ल और क्षार की ताकत पर निर्भर करता है जिसका उपयोग किया गया है। यदि अम्ल मजबूत है और क्षार कमजोर है, तो निष्कर्षित समाधान अम्लीय होगा। यदि क्षार मजबूत है और अम्ल कमजोर है, तो निष्कर्षित समाधान क्षारीय होगा। यदि अम्ल और क्षार दोनों समान रूप से मजबूत या कमजोर हैं, तो निष्कर्षित समाधान तटस्थ होगा।
(e) धात्विक ऑक्साइड का अम्लों के साथ अभिक्रिया
(e) धात्विक ऑक्साइड का अम्लों के साथ अभिक्रिया
धात्विक ऑक्साइड + अम्ल → नमक + पानी
CaO + 2HCl → CaCl2 + H2O
(f) अधात्विक ऑक्साइड का क्षारों के साथ अभिक्रिया
(f) अधात्विक ऑक्साइड का क्षारों के साथ अभिक्रिया
अधात्विक ऑक्साइड + क्षार → नमक + पानी
SO2 + 2NaOH → Na2SO3 + H2O
- अधात्विक ऑक्साइड स्वभाव में अम्लीय होते हैं।
- अधात्विक ऑक्साइड + क्षार → नमक + H2O
- CO2 + Ca(OH)2 → CaCO3 + H2O
कुछ अम्लों की अभिक्रियाएँ:
- (i) अम्ल + धातु कार्बोनेट → नमक + CO2 + पानी
- (ii) अम्ल + धातु → नमक + H2
- (iii) अम्ल + धातु हाइड्रोजन कार्बोनेट → नमक + CO2 + H2O
- (iv) अम्ल + धात्विक ऑक्साइड → नमक + H2O
- (v) अम्ल + क्षार → नमक + H2O
कुछ क्षारों की अभिक्रियाएँ:
- (i) क्षार + धातु → नमक + H2
- (ii) क्षार + धातु कार्बोनेट → कोई अभिक्रिया नहीं
- (iii) क्षार + धातु हाइड्रोजन कार्बोनेट → कोई अभिक्रिया नहीं
- (iv) क्षार + अम्ल → नमक + H2O
- (v) क्षार + अधात्विक ऑक्साइड → नमक + H2O
सभी अम्लों और क्षारों में क्या समानता है?
सभी अम्ल और क्षार में क्या समानता है?
- अम्ल और क्षार दोनों को इलेक्ट्रोलाइट्स के रूप में वर्गीकृत किया जा सकता है। इसका अर्थ है कि वे पानी में घुलने पर बिजली का संचालन कर सकते हैं।
- अम्ल और क्षार एक-दूसरे के साथ प्रतिक्रिया कर सकते हैं जिससे नमक और पानी बनता है। इस प्रतिक्रिया को न्यूट्रलाइजेशन प्रतिक्रिया कहा जाता है।
- अम्ल और क्षार कुछ संकेतकों का रंग बदल सकते हैं। उदाहरण के लिए, अम्ल लिटमस कागज को नीले से लाल में बदल देते हैं, जबकि क्षार इसे लाल से नीला में बदल देते हैं।
- अम्ल और क्षार दोनों ही मजबूत या कमजोर हो सकते हैं। अम्ल या क्षार की ताकत इस पर निर्भर करती है कि वे पानी में घुलने पर कितने हाइड्रोजन आयन (H+) या हाइड्रॉक्साइड आयन (OH-) उत्पन्न करते हैं।
- अम्ल और क्षार कई रासायनिक प्रतिक्रियाओं में महत्वपूर्ण होते हैं। उदाहरण के लिए, अम्ल का उपयोग बैटरियों में किया जाता है, जबकि क्षार का उपयोग साफ करने वाले पदार्थों में किया जाता है।
- अम्ल पानी की उपस्थिति में H+ आयन उत्पन्न करते हैं।
- H+ आयन अकेले नहीं रह सकते, वे H3O (हाइड्रोनियम आयन) के रूप में मौजूद होते हैं। H + H2O → H3O HCl + H2O → H3O + Cl-
- क्षार पानी में घुलने पर OH- आयन देते हैं।
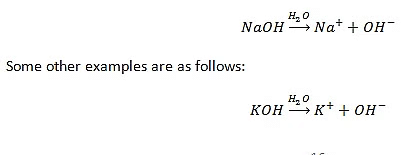
- पानी में घुलनशील क्षार को अल्कलिस कहा जाता है।
- अम्लों को पतला करते समय, यह सिफारिश की जाती है कि अम्ल को पानी में डाला जाए, न कि इसके विपरीत, क्योंकि पानी में अम्ल या क्षार को घोलने की प्रक्रिया अत्यधिक ऊष्मीय होती है।
- अब जब हमने पहचान लिया है कि सभी अम्ल H+ (aq) उत्पन्न करते हैं और सभी क्षार OH- (aq) उत्पन्न करते हैं, हम न्यूट्रलाइजेशन प्रतिक्रिया को इस प्रकार देख सकते हैं – अम्ल + क्षार → नमक + पानी
Hx M OH → MX + HOH
एच (aq) ओएच – (aq) → एच2ओ(l)
पानी में किसी एसिड या बेस को घोलना एक अत्यंत उष्माघाती प्रतिक्रिया है, जिसका अर्थ है कि यह बहुत अधिक गर्मी छोड़ता है। जब केंद्रित नाइट्रिक या सल्फ्यूरिक एसिड को पानी के साथ मिलाया जाता है, तो यह महत्वपूर्ण है कि एसिड को धीरे-धीरे पानी में मिलाते समय निरंतर हिलाते रहें। केंद्रित एसिड में पानी डालने से मिश्रण बहुत गर्म हो सकता है, जो इसे छिड़कने का कारण बन सकता है और इससे जलन हो सकती है। इसके अलावा, तीव्र गर्मी से कांच का कंटेनर भी टूट सकता है।
एसिड या बेस समाधानों की ताकत कितनी होती है? किसी एसिड या बेस की ताकत का अनुमान एक यूनिवर्सल संकेतक का उपयोग करके लगाया जा सकता है।
अम्ल या क्षार समाधानों की ताकत कितनी होती है?
- यूनिवर्सल संकेतक: यह कई संकेतकों का मिश्रण है। यह समाधान में H आयनों के विभिन्न सांद्रण पर विभिन्न रंग दिखाता है।
- pH स्केल: यह समाधान में H आयन के सांद्रण को मापने के लिए एक स्केल है। pH में p का अर्थ है ‘potenz’, जो एक जर्मन शब्द है जिसका अर्थ है शक्ति।
- यदि pH का मान 7 के बराबर है → तटस्थ समाधान
- यदि pH का मान 7 से कम है → अम्लीय समाधान
- यदि pH का मान 7 से अधिक है → क्षारीय समाधान
H (aq) और OH– (aq) आयनों की सांद्रता में परिवर्तन के साथ pH का परिवर्तन
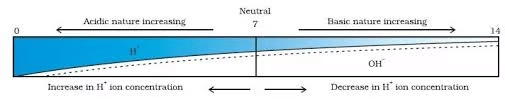
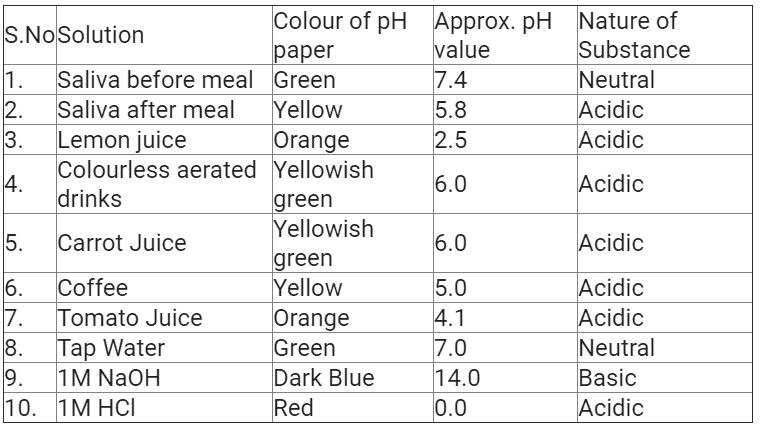
कुछ सामान्य पदार्थों के pH का चित्र pH पेपर पर दिखाया गया है (रंग केवल एक मोटा मार्गदर्शक हैं)
अम्लों और क्षारों की ताकत संबंधित H आयनों और OH– आयनों की संख्या पर निर्भर करती है। यदि हम हाइड्रोक्लोरिक अम्ल और एसीटिक अम्ल को एक ही सांद्रता, जैसे एक मोलर लेते हैं, तो ये विभिन्न मात्रा में हाइड्रोजन आयन बनाते हैं। जो अम्ल अधिक H आयन उत्पन्न करते हैं उन्हें मजबूत अम्ल कहा जाता है, और जो अम्ल कम H आयन उत्पन्न करते हैं उन्हें कमजोर अम्ल कहा जाता है। मजबूत क्षार समाधान में अधिक OH- उत्पन्न करते हैं क्योंकि वे पूरी तरह से प्रोटॉन स्वीकार करते हैं।
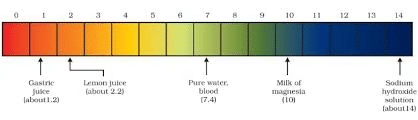
पौधों और जानवरों की संवेदनशीलता: pH स्तर का पौधों और जानवरों पर महत्वपूर्ण प्रभाव पड़ता है। कई महत्वपूर्ण जैविक प्रक्रियाएं, जिनमें एंजाइम और हार्मोन की गतिविधि के साथ-साथ पाचन भी शामिल है, को सही ढंग से कार्य करने के लिए एक विशेष pH रेंज की आवश्यकता होती है। इसका मतलब है कि pH में थोड़े-से बदलाव से जीवित जीवों के समग्र स्वास्थ्य और कल्याण पर बड़ा प्रभाव पड़ सकता है।
- मिट्टी: पौधों या फसलों की वृद्धि का समर्थन करने के लिए मिट्टी का आदर्श pH रेंज 6.5 से 7.0 के बीच होता है।
- पाचन तंत्र: हमारे पेट में पाचन प्रक्रिया के दौरान, उचित पाचन के लिए 1.5 से 4 के बीच का एक विशेष pH रेंज आवश्यक होता है। भोजन के टूटने में मदद करने वाली एंजाइम प्रतिक्रियाओं का pH स्तर पेट में हाइड्रोक्लोरिक एसिड (HCl) की उपस्थिति से प्रभावित होता है।
- दांतों का क्षय: जब दांतों के चारों ओर के वातावरण का pH 5.5 या उससे कम हो जाता है, तो दांतों का क्षय हो सकता है।
- पौधों और जानवरों द्वारा आत्म-रक्षा: जानवरों और पौधों द्वारा आत्म-रक्षा तंत्र के रूप में अम्लीय पदार्थों का उपयोग किया जाता है। उदाहरण के लिए, मधुमक्खियाँ और जैसे पौधे, जैसे कि चिचिंदा, आत्म-रक्षा के लिए एक अत्यधिक अम्लीय पदार्थ का स्राव करते हैं। इन स्रावित अम्लीय पदार्थों का एक विशिष्ट pH होता है।
परिभाषा: इसे एक ऐसा पदार्थ माना जाता है जो गंधहीन, स्वाद में नमकीन और पानी में घुलनशील होता है। इसका pH मान 7 के बराबर होता है। उदाहरण:
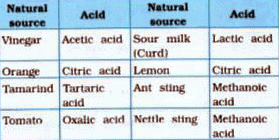
जब साल्ट में या तो वही कैटियन या एनियन होते हैं, तो उन्हें एक ही परिवार के सदस्य के रूप में वर्गीकृत किया जाता है। उदाहरण के लिए, साल्ट जैसे NaCl, KCl, और LiCl को एक ही परिवार का हिस्सा माना जाएगा क्योंकि इनमें समान एनियन होता है, जो कि क्लोराइड (Cl-) है। साल्ट को उनके साझा कैटियनों या एनियनों के आधार पर वर्गीकृत करने का यह सिद्धांत रसायन विज्ञान में महत्वपूर्ण है और विभिन्न साल्ट के अध्ययन को सरल बनाने में मदद करता है।
सामान्यतः नमक के रूप में जाना जाने वाला सोडियम क्लोराइड का आणविक सूत्र NaCl है और यह हमारे आहार में एक मौलिक तत्व है। यह कई खाद्य पदार्थों में स्वाद बढ़ाने और संरक्षक के रूप में कार्य करता है। नमक से चार अलग-अलग यौगिक बनाए जा सकते हैं।
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2 (g) + H2 (g)
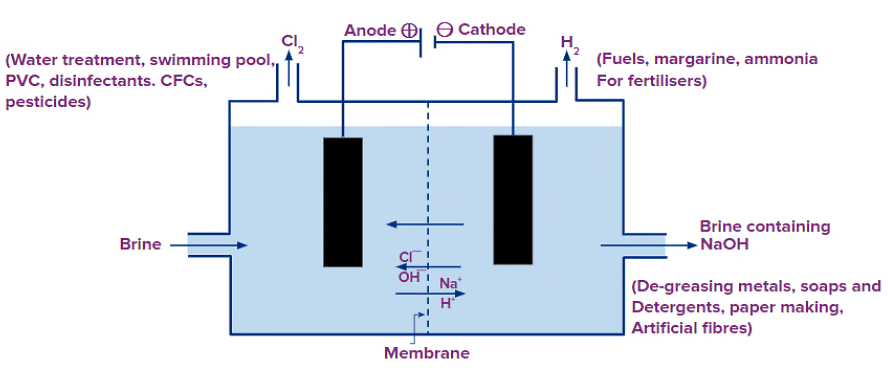
- यह धुलाई में धुंधले कपड़ों को सफेद करने के लिए और वस्त्र उद्योग में कपास और लिनन को ब्लीच करने के लिए इसके ब्लीचिंग गुणों के कारण उपयोग किया जाता है।
- इसके मजबूत ऑक्सीडाइजिंग क्षमताओं के कारण, यह कई उद्योगों में एक ऑक्सीडाइज़र के रूप में काम करता है।
- यह पानी को पीने योग्य बनाने के लिए एक कीटाणुनाशक के रूप में उपयोग किया जाता है, जिससे हानिकारक सूक्ष्मजीवों को समाप्त किया जा सके।
सोडियम बाइकार्बोनेट, जिसे बेकिंग सोडा या सोडियम बाइकार्बोनेट कहा जाता है, एक प्रकार का रासायनिक यौगिक है जिसे सूत्र NaHCO3 से दर्शाया जाता है और इसे IUPAC द्वारा सोडियम हाइड्रोजन कार्बोनेट नाम दिया गया है। यह यौगिक एक सोडियम कैटियन (Na+) और एक बाइकार्बोनेट एनियन (HCO3-) के संयोजन से बनता है। सामान्यतः, सोडियम बाइकार्बोनेट एक बारीक सफेद पाउडर के रूप में प्रकट होता है जिसमें थोड़ा नमकीन और क्षारीय स्वाद होता है, जो सोडियम कार्बोनेट या वाशिंग सोडा के समान है।
NaCl H2O CO2 NH3 → NH4 Cl NaHCO3
जब इसे पकाने के दौरान गर्म किया जाता है:
2NaHCO3 → Na2CO3 H2O CO2
- बेकिंग पाउडर बनाने के लिए, जो बेकिंग सोडा (सोडियम हाइड्रोजनकार्बोनेट) और एक हल्की खाद्य अम्ल जैसे टार्टरिक एसिड का मिश्रण है। जब बेकिंग पाउडर को गर्म किया जाता है या पानी में मिलाया जाता है, तो निम्नलिखित प्रतिक्रिया होती है –
NaHCO3 H → CO2 H2O अम्ल का सोडियम लवण
(किसी भी अम्ल से)
- प्रतिक्रिया के दौरान उत्पन्न कार्बन डाइऑक्साइड ब्रेड या केक को उठाने का कारण बन सकता है, जिससे वे नरम और स्पंजी बनते हैं।
- सोडियम हाइड्रोजनकार्बोनेट भी एंटासिड में एक तत्व है। यह क्षारीय होने के कारण, पेट में अतिरिक्त अम्ल को न्यूट्रलाइज करता है और राहत प्रदान करता है।
- यह सोडा-एसिड अग्निशामक में भी इस्तेमाल किया जाता है।
सोडियम कार्बोनेट, जिसे वाशिंग सोडा के रूप में भी जाना जाता है, एक और रासायनिक पदार्थ है जिसे सोडियम क्लोराइड से प्राप्त किया जा सकता है। जैसा कि पहले उल्लेख किया गया, बेकिंग सोडा को गर्म करके सोडियम कार्बोनेट उत्पन्न किया जा सकता है, जिसे फिर पुनः क्रिस्टलीकृत करके वाशिंग सोडा के हाइड्रेटेड रूप Na2CO3.10H2O में प्राप्त किया जा सकता है। सोडियम कार्बोनेट के समान, वाशिंग सोडा भी एक मूल नमक है जिसमें क्षारीय गुण होते हैं।
Na2CO3 · H2O → Na2CO3 · 10H2O
- यह कांच, साबुन और कागज़ उद्योगों में उपयोग किया जाता है।
- यह स्थायी जल कठोरता की समस्या को समाप्त करने के लिए प्रयोग किया जाता है।
जब कुछ लवण एक विशेष मात्रा में पानी के साथ मिलते हैं, तो वे क्रिस्टल बना सकते हैं। जो पानी लवण के साथ मिलकर क्रिस्टल बनाता है, उसे क्रिस्टलीकरण का पानी कहा जाता है। क्रिस्टलीकरण एक प्रक्रिया है जिसमें एक ठोस पदार्थ का निर्माण होता है, जहाँ परमाणु या अणु एक मजबूत संरचना में व्यवस्थित होते हैं जिसे क्रिस्टल कहा जाता है। यह समाधान से अवक्षिप्त होने, जमने, या कभी-कभी गैस से सीधे जमा होने के द्वारा हो सकता है।

उदाहरण: टेबल नमक, जिसे सोडियम क्लोराइड या हेलाइट क्रिस्टल के रूप में जाना जाता है, सुक्रोज के रूप में चीनी, और बर्फ के टुकड़े सभी ऐसे सामग्रियों के परिचित उदाहरण हैं जिनकी क्रिस्टल संरचना होती है। इसी तरह, कई कीमती और अर्ध-कीमती रत्न, जैसे कि हीरा और क्वार्ट्ज, को उनके अणुओं या परमाणुओं की भली भांति परिभाषित आंतरिक व्यवस्था के कारण क्रिस्टल के रूप में वर्गीकृत किया जाता है।
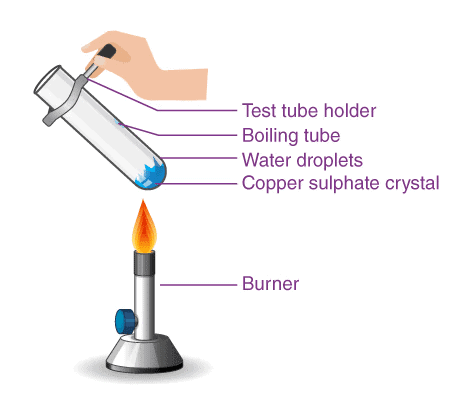
1. तांबे के सल्फेट के क्रिस्टल तांबे के सल्फेट के क्रिस्टल, जो सूखे लगते हैं, क्रिस्टलीकरण के पानी को समाहित करते हैं। जब हम इन क्रिस्टलों को गर्म करते हैं, तो यह पानी हटा दिया जाता है और नमक सफेद हो जाता है। अगर आप इन क्रिस्टलों को फिर से पानी से नम करें, तो आप देखेंगे कि क्रिस्टलों का नीला रंग फिर से प्रकट हो जाता है। क्रिस्टलीकरण के पानी को हटाना क्रिस्टलीकरण का पानी उस विशेष संख्या के पानी के अणुओं को संदर्भित करता है जो प्रत्येक लवण के सूत्र इकाई के भीतर बंधे होते हैं। तांबे के सल्फेट के लिए, प्रत्येक सूत्र इकाई में पाँच पानी के अणु होते हैं, और इसका रासायनिक सूत्र CuSO₄·5H₂O है।
1. तांबे के सल्फेट के क्रिस्टल
तांबे के सल्फेट के क्रिस्टल, जो सूखे दिखाई देते हैं, उनमें क्रिस्टलीकरण का पानी होता है। जब हम इन क्रिस्टलों को गर्म करते हैं, तो यह पानी हटा दिया जाता है और नमक सफेद हो जाता है। यदि आप इन क्रिस्टलों को फिर से पानी से नम करें, तो आप पाएंगे कि क्रिस्टलों का नीला रंग फिर से प्रकट हो जाता है।
क्रिस्टलीकरण का पानी हटाना का तात्पर्य उस विशेष संख्या से है जो पानी के अणुओं की होती है जो हर नमक की सूत्र इकाई के भीतर बंधी होती है। तांबे के सल्फेट के लिए, प्रत्येक सूत्र इकाई में पाँच पानी के अणु होते हैं, और इसका रासायनिक सूत्र CuSO₄·5H₂O है।
यह अवधारणा यह निर्धारित करने में मदद कर सकती है कि क्या Na₂CO₃·10H₂O, वाशिंग सोडा गीला है। क्रिस्टलीकरण के पानी के साथ नमक का एक और उदाहरण जिप्सम है, जिसमें प्रत्येक सूत्र इकाई में दो पानी के अणु होते हैं। इसका रासायनिक सूत्र CaSO₄·2H₂O है। चलिए, जिप्सम के उपयोगों की खोज करते हैं।
प्लास्टर ऑफ पेरिस एक सामान्य रूप से उपयोग होने वाला रासायनिक यौगिक है जो शिल्प सामग्री और गॉज बैंडेज में व्यापक रूप से उपयोग किया जाता है। यह वास्तव में हाइड्रेटेड कैल्शियम सल्फेट का एक सफेद पाउडर है, जो जिप्सम को कैल्सिनिंग करके प्राप्त किया जाता है। हालांकि हम अपने दैनिक जीवन में प्लास्टर ऑफ पेरिस का अक्सर सामना करते हैं, इसका रासायनिक संघटन हाइड्रेटेड कैल्शियम सल्फेट के रूप में वर्णित किया जा सकता है, जो जिप्सम से निकाला जाता है जिसे निर्माण के दौरान उच्च तापमान के अधीन किया गया है।
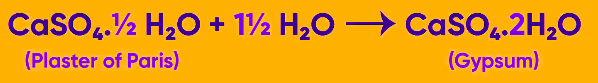
जिप्सम प्लास्टर और प्लास्टर ऑफ पेरिस वास्तव में एक ही चीज़ हैं। प्लास्टर ऑफ पेरिस का रासायनिक सूत्र CaSO4·½H2O है। यदि जिप्सम (CaSO₄·2H₂O (s)) को 100°C (373K) के तापमान पर गर्म किया जाए, तो यह एक अभिक्रिया के अधीन होता है जो CaSO₄·½H₂O और 3/2 H₂O उत्पन्न करती है। जब यौगिक CaSO₄·½H₂O का निर्माण होता है, तब प्लास्टर ऑफ पेरिस बनता है। इस यौगिक का रासायनिक सूत्र यह दर्शाता है कि दो इकाइयाँ CaSO₄ एक पानी के अणु को साझा करती हैं।
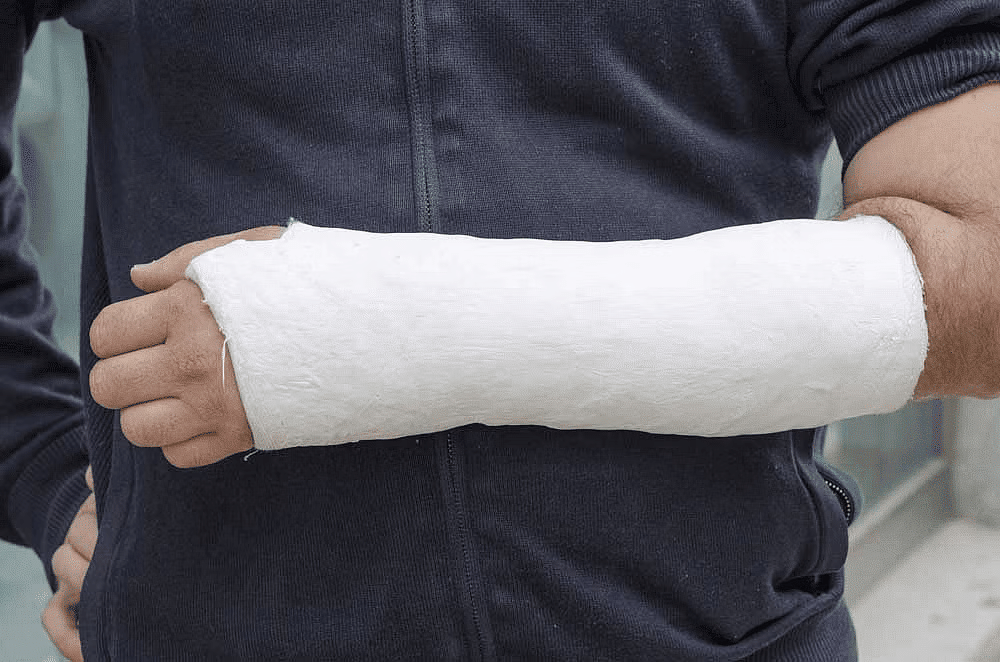
- चिकित्सकीय कास्टिंग: प्लास्टर ऑफ पेरिस का अक्सर ऑर्थोपेडिक चिकित्सा में टूटे हुए हड्डियों के लिए कास्ट बनाने के लिए उपयोग किया जाता है। जब इसे पानी के साथ मिलाया जाता है, तो यह एक पेस्ट बनाता है जिसे चोटिल क्षेत्र के चारों ओर वांछित आकार में ढाला जा सकता है। फिर प्लास्टर कठोर हो जाता है और एक मजबूत कास्ट बनाता है जो हड्डी को ठीक होने में मदद करता है।
- शिल्पकला और कला: प्लास्टर ऑफ पेरिस शिल्पकला और कला में एक लोकप्रिय सामग्री है। इसे विभिन्न आकारों और बनावटों में ढाला जा सकता है और यह जल्दी सूखता है, जिससे जटिल डिजाइनों के लिए यह एक सुविधाजनक विकल्प बनता है। कलाकार अक्सर इसका उपयोग कास्ट, मास्क और अन्य सजावटी टुकड़े बनाने के लिए करते हैं।
- गृह सजावट: प्लास्टर ऑफ पेरिस का उपयोग गृह सजावट के लिए भी किया जाता है। इसका उपयोग सजावटी दीवार के उच्चारण, छत के टाइलों और अन्य वास्तु विवरण बनाने के लिए किया जा सकता है। प्लास्टर ऑफ पेरिस का उपयोग सजावटी आकृतियों, सजावट और अन्य शिल्प बनाने के लिए भी किया जा सकता है। इसकी बहुविधता और उपयोग में आसानी इसे DIY परियोजनाओं के लिए एक लोकप्रिय विकल्प बनाती है।
प्रश्न 1. एसिड क्या है? उत्तर. एसिड एक रासायनिक पदार्थ है जो रासायनिक प्रतिक्रिया में हाइड्रोजन आयनों (H+) या प्रोटनों का दान करता है। एसिड का pH 7 से कम होता है और इसका स्वाद खट्टा होता है। एसिड के उदाहरणों में हाइड्रोक्लोरिक एसिड, सल्फ्यूरिक एसिड और एसीटिक एसिड शामिल हैं।
प्रश्न 2: एक आधार क्या है? उत्तर: एक आधार एक रासायनिक पदार्थ है जो हाइड्रोजन आयन (H+) को स्वीकार करता है या रासायनिक प्रतिक्रिया में हाइड्रॉक्साइड आयन (OH-) को दान करता है। आधारों का pH 7 से अधिक होता है और इनका स्वाद कड़वा होता है। आधारों के उदाहरणों में सोडियम हाइड्रॉक्साइड, पोटेशियम हाइड्रॉक्साइड, और कैल्शियम हाइड्रॉक्साइड शामिल हैं।
प्रश्न 3: एक नमक क्या है? उत्तर: एक नमक एक रासायनिक यौगिक है जो तब बनता है जब एक अम्ल एक आधार के साथ प्रतिक्रिया करता है। यह आयनों से बना होता है, जो तब बनते हैं जब अम्ल और आधार एक-दूसरे को न्यूट्रलाइज करते हैं। सबसे सामान्य नमक सोडियम क्लोराइड (टेबल नमक) है, जो तब बनता है जब हाइड्रोक्लोरिक अम्ल सोडियम हाइड्रॉक्साइड के साथ प्रतिक्रिया करता है।
प्रश्न 4: pH स्केल क्या है? उत्तर: pH स्केल किसी समाधान की अम्लता या क्षारीयता का माप है। यह 0 से 14 तक होती है, जिसमें 0 सबसे अम्लीय, 7 तटस्थ, और 14 सबसे क्षारीय होता है। pH स्केल लॉगरिदमिक होती है, जिसका मतलब है कि एक pH यूनिट का परिवर्तन अम्लता या क्षारीयता में दस गुना परिवर्तन का प्रतिनिधित्व करता है।
प्रश्न 5: अम्लों, आधारों, और नमकों के कुछ सामान्य उपयोग क्या हैं? उत्तर: अम्लों का सामान्य उपयोग उर्वरकों, रंगों, और प्लास्टिक के उत्पादन में किया जाता है। इन्हें खाद्य उद्योग में कुछ खाद्य पदार्थों को खट्टा स्वाद देने के लिए भी उपयोग किया जाता है। आधारों का उपयोग साबुन, डिटर्जेंट, और सफाई उत्पादों के उत्पादन में किया जाता है। इन्हें कृषि में अम्लीय मिट्टी को न्यूट्रलाइज करने के लिए भी उपयोग किया जाता है। नमकों का उपयोग खाद्य उद्योग में संरक्षक और स्वाद सुधारक के रूप में किया जाता है। इन्हें कांच, सिरेमिक, और धातु विज्ञान के उत्पादन में भी उपयोग किया जाता है।
|
1 videos|326 docs|212 tests
|















