NCERT सारांश: धातु और अधातु | विज्ञान और प्रौद्योगिकी (Science & Technology) for UPSC CSE PDF Download
परिचय
कल्पना करें कि चूल्हे पर गर्म हो रहे एक कुकिंग पॉट की चमकदार सतह या आपके लंच को लपेटने वाले एल्युमिनियम फॉयल की खड़खड़ाहट। ये रोज़मर्रा की वस्तुएँ यह दिखाती हैं कि हमारे जीवन में धातुओं का कितना महत्त्व है। अब, उस पॉट के रबर के हैंडल या आपके द्वारा साँस में लिए जाने वाले ऑक्सीजन पर विचार करें—ये दोनों गैर-धातुओं के काम करने के उदाहरण हैं।
जब आप तत्वों को धातुओं या गैर-धातुओं के रूप में वर्गीकृत करते हैं, तो आप शायद उनके रूप, चालकता, और प्रतिक्रिया के बारे में सोचते हैं। लोहे और तांबे जैसी धातुएँ चमकदार होती हैं, गर्मी और बिजली को अच्छे से संचारित करती हैं, और इन्हें आसानी से आकार में ढाला जा सकता है, जिससे ये तारों, बर्तनों, और निर्माण सामग्री के लिए आदर्श होती हैं।
दूसरी ओर, सल्फर और कार्बन जैसी गैर-धातुएँ आमतौर पर सुस्त, खराब चालक, और भंगुर होती हैं, यही कारण है कि इन्हें इंसुलेशन, ईंधनों, और यहां तक कि हमारे भोजन में भी उपयोग किया जाता है। इन तत्वों के गुण उनके दैनिक उपयोगों को निर्धारित करते हैं, जिससे आपकी पढ़ाई सीधे आपके चारों ओर की दुनिया से जुड़ जाती है।

भौतिक गुण
भौतिक गुण वे विशेषताएँ हैं जो हम देख सकते हैं या माप सकते हैं बिना सामग्री की मूल पहचान को बदले। कल्पना करें कि आपके पास एक टुकड़ा चॉकलेट है। इसकी कुछ भौतिक विशेषताएँ हैं: रंग, संरचना, कठोरता, पिघलने का बिंदु, स्वाद, घनत्व, अपारदर्शिता।
(क) धातुएँ:
धातुएँ अपनी अनोखी विशेषताओं के लिए जानी जाती हैं:
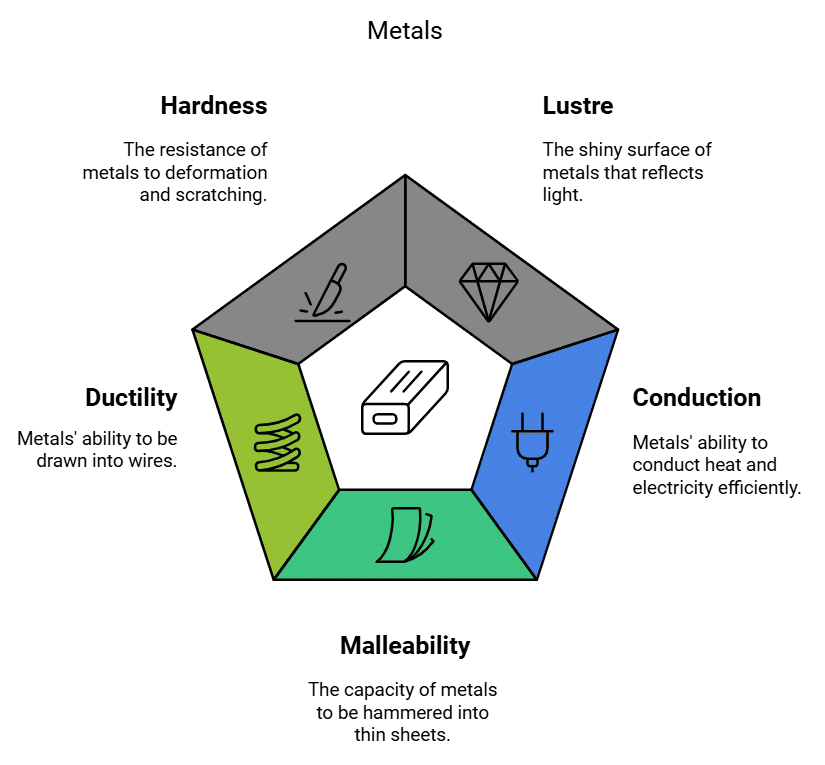
- चमक: धातुओं की सतह चमकदार और परावर्तक होती है, जिसे अक्सर धात्विक चमक के रूप में वर्णित किया जाता है। यह विशेषता उन्हें विभिन्न उपयोगों के लिए आकर्षक और मूल्यवान बनाती है, जैसे गहनों और सिक्कों में।
धातुएँ चमकदार होती हैं।
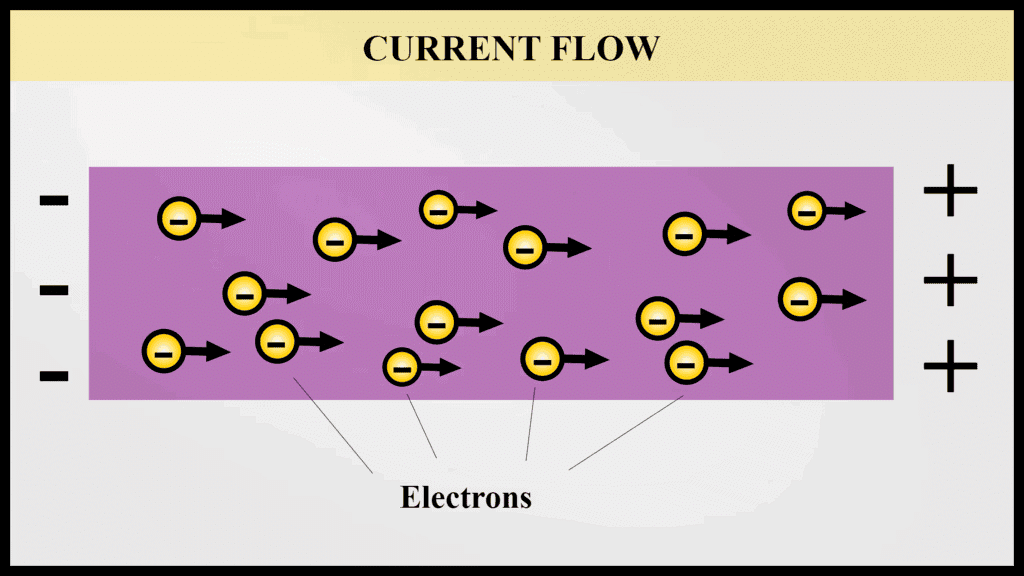
2. संवहन (ताप और विद्युत): धातुएँ गर्मी और विद्युत की उत्कृष्ट संवाहक होती हैं। वे गर्मी और विद्युत धारा को न्यूनतम प्रतिरोध के साथ प्रवाहित होने देती हैं। यह विशेषता उन्हें विद्युत तारों और खाना पकाने के बर्तनों में आवश्यक बनाती है। चाँदी और तांबा गर्मी के सर्वश्रेष्ठ संवाहक हैं। सीसा और पारा तुलनात्मक रूप से गर्मी के खराब संवाहक होते हैं।
क्या आप जानते हैं कि वे गर्मी और विद्युत के अच्छे संवाहक क्यों हैं?
धातुएँ विद्युत का संवहन करती हैं क्योंकि इनमें मुक्त इलेक्ट्रॉनों की उपस्थिति होती है।
धातुओं की संवहनता के कारण, विद्युत तार (जो ज्यादातर तांबा, एल्यूमिनियम, इस्पात, चाँदी से बने होते हैं) को पॉलीविनाइल क्लोराइड (PVC) से कोट किया जाता है ताकि विद्युत झटके और अन्य दुर्घटनाओं से बचा जा सके। PVC एक इंसुलेटर है, जिसका अर्थ है कि यह विद्युत का संवहन नहीं करता, इसलिए यदि आप तार को छूते हैं, तो धारा आपके माध्यम से नहीं गुजरेगी। PVC आग प्रतिरोधी भी है और इसे उपयोग करना आसान है, और यह लगभग 40 वर्षों तक चल सकता है।
3. मोलनीयता: धातुओं को बिना टूटे पतले पत्तों में हथौड़े या लुढ़का जा सकता है। इस विशेषता को मोलनीयता कहा जाता है और यह धातुओं को विभिन्न आकारों में आकार देने की अनुमति देती है, जैसे अलuminum फॉयल और तांबे के पत्ते। सोना और चाँदी सबसे अधिक मोलनीय धातुएँ हैं।
4. डक्टिलिटी: धातुओं को बिना टूटे पतले तारों में खींचा जा सकता है। इस विशेषता को डक्टिलिटी कहा जाता है और यह विद्युत प्रयोजनों के लिए तार बनाने में महत्वपूर्ण है, जैसे कि विद्युत केबलों में तांबे के तार। सोना सबसे अधिक डक्टाइल धातु है (एक ग्राम सोने से लगभग 2 किमी लंबा तार खींचा जा सकता है।)
5. कठोरता: किसी धातु की कठोरता का अर्थ है उसकी स्थानीय प्लास्टिक विकृति, टूटने और नुकसान को सहन करने की क्षमता। यह यह भी निर्धारित करता है कि किसी सामग्री की सतह कितनी अच्छी तरह से पहनने और घिसने का प्रतिरोध करती है। जबकि अधिकांश धातुएँ अपेक्षाकृत कठोर होती हैं, वे धातु से धातु में कठोरता में भिन्न होती हैं। उदाहरण के लिए, आयरन और तांबा कमरे के तापमान पर कठोर होते हैं, लेकिन सोडियम इतना नरम होता है कि इसे चाकू से काटा जा सकता है।



6. ध्वनि गुणता: ध्वनि गुणता वह विशेषता है जिसके कारण धातुओं को जब एक कठोर सतह पर मारा जाता है, तो वे ध्वनि उत्पन्न करती हैं। जो धातुएँ ध्वनि गुणता दिखाती हैं, उन्हें ध्वन्युक्त माना जाता है। अधिकांश धातुएँ ध्वन्युक्त होती हैं, और कुछ उदाहरणों में शामिल हैं: तांबा, एल्यूमिनियम, टिन, चांदी और लोहे।
7. घनत्व: धातुएँ आमतौर पर घनत्व में उच्च होती हैं, अर्थात् उनके आकार के हिसाब से उनका भार तुलनात्मक रूप से अधिक होता है। यह विशेषता उन्हें भारी मशीनरी और संरचनात्मक घटकों के निर्माण के लिए उपयुक्त बनाती है।
8. पिघलने और उबलने के बिंदु: धातुओं के सामान्यतः उच्च पिघलने और उबलने के बिंदु होते हैं। उदाहरण के लिए, लोहे का पिघलने का तापमान लगभग 1,535 डिग्री सेल्सियस है। धातुओं की संरचना घनी होती है और उनके बीच अंतराण्विक आकर्षण की एक मजबूत शक्ति होती है। इस आकर्षण को तोड़ने के लिए अधिक गर्मी की आवश्यकता होती है, इसलिए उनके पिघलने के बिंदु उच्च होते हैं, सिवाय कुछ धातुओं जैसे गैलियम और सीज़ियम के।
(b) गैर-धातुएँ:
गैर-धातुओं में, दूसरी ओर, धातुओं से काफी अलग विशेषताएँ होती हैं:
- चमक की कमी: गैर-धातुओं में धातुओं की तरह चमकदार उपस्थिति नहीं होती; इसके बजाय, वे मैट या विभिन्न रंगों में हो सकते हैं।
- खराब चालक: गैर-धातुएँ सामान्यतः गर्मी और बिजली की खराब चालक होती हैं। ये स्वतंत्र इलेक्ट्रॉनों की कमी के कारण विद्युत धारा के प्रवाह की अनुमति नहीं देती हैं, सिवाय ग्रेफाइट के।
- भंगुरता: कई गैर-धातुएँ भंगुर होती हैं और बल लगाने पर टूटने या चूर-चूर होने की प्रवृत्ति रखती हैं। उदाहरण के लिए, सल्फर और फॉस्फोरस भंगुर गैर-धातुएँ हैं। गैर-धातुएँ मैलियाबल या डक्टाइल नहीं होती हैं।

4. कम घनत्व: अधातु (Non-metals) सामान्यतः धातुओं की तुलना में कम घनत्व रखते हैं। इसका मतलब है कि उनके पास दिए गए आयतन के लिए कम द्रव्यमान होता है।
5. कम पिघलने और उबलने के बिंदु: अधातुओं के पिघलने और उबलने के बिंदु अक्सर कम होते हैं। अधातु कमजोर अंतःआणविक आकर्षण बल द्वारा बंधे होते हैं, इसलिए उन्हें तोड़ने के लिए कम गर्मी की आवश्यकता होती है। परिणामस्वरूप, उनके पिघलने के बिंदु कम होते हैं।
6. विभिन्न अवस्थाएँ: अधातु कमरे के तापमान पर विभिन्न अवस्थाओं में मौजूद हो सकते हैं। उदाहरण के लिए, ऑक्सीजन एक गैस है, जबकि ब्रोमीन एक तरल है, और सल्फर एक ठोस है।
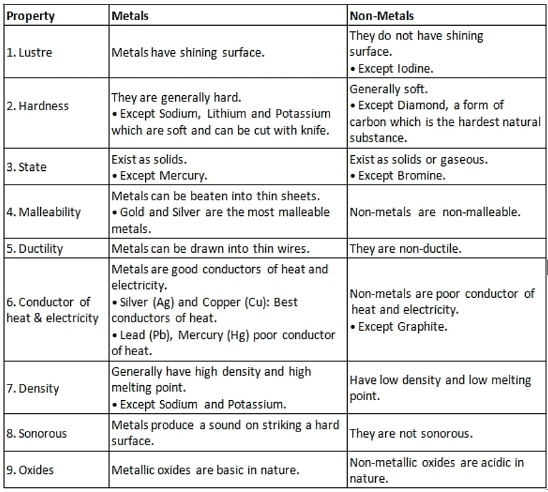
इन भौतिक गुणों को समझना आवश्यक है क्योंकि ये तत्वों को धातु या अधातु के रूप में वर्गीकृत करने के लिए आधार बनाते हैं। ये गुण हमारे दैनिक जीवन और विभिन्न उद्योगों में इन तत्वों के विभिन्न अनुप्रयोगों को भी निर्धारित करते हैं। आपके संदर्भ के लिए धातुओं और अधातुओं के मुख्य गुणों का सारांश तालिका नीचे दी गई है।
हम तत्वों को केवल उनके भौतिक गुणों के आधार पर वर्गीकृत नहीं कर सकते, क्योंकि कई अपवाद हैं।
- सभी धातुएँ, सिवाय पारा (तरल) के, कमरे के तापमान पर ठोस रूप में होती हैं क्योंकि धातुओं के पिघलने के बिंदु उच्च होते हैं, लेकिन गैलियम और सीजियम के पिघलने के बिंदु बहुत कम होते हैं। यदि आप इन्हें अपनी हथेली पर रखते हैं, तो ये दो धातुएँ पिघल जाएँगी।
- आयोडीन एक अधातु है, लेकिन यह चमकदार है।
कार्बन एक अधातु है जो विभिन्न रूपों में अस्तित्व में रह सकता है। प्रत्येक रूप को अलोट्रोप कहा जाता है। कार्बन का एक अलोट्रोप, हीरा, ज्ञात प्राकृतिक पदार्थों में सबसे कठिन है और इसका पिघलने और उबलने का बिंदु बहुत उच्च है। ग्रेफाइट, कार्बन का एक अन्य अलोट्रोप, विद्युत का चालक है।
अल्कली धातुएँ (लिथियम, सोडियम, पोटेशियम) इतनी नरम होती हैं कि इन्हें चाकू से काटा जा सकता है। इनका घनत्व कम होता है और पिघलने के बिंदु भी कम होते हैं। (अल्कली धातुएँ रासायनिक तत्वों का एक समूह हैं जो आवर्त सारणी के पहले कॉलम में स्थित हैं, जिसे समूह 1 भी कहा जाता है।)
तत्वों को उनकी रासायनिक गुणों के आधार पर अधिक स्पष्ट रूप से धातु और अधातु के रूप में वर्गीकृत किया जा सकता है।

धातुओं के रासायनिक गुण
(क) धातुओं की हवा के साथ प्रतिक्रिया
धातुएँ ऑक्सीजन के साथ मिलकर धातु ऑक्साइड बनाती हैं। धातु + O2 → धातु ऑक्साइड उदाहरण: विभिन्न धातुओं की O2 के साथ प्रतिक्रियाशीलता अलग-अलग होती है।
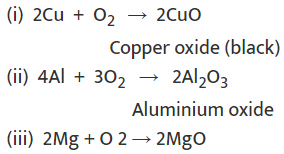
- Na और K इतनी तेजी से प्रतिक्रिया करते हैं कि वे हवा के संपर्क में आने पर जलने लगते हैं; इसलिए, इन्हें केरोसिन में डूबा कर रखा जाता है।
- Mg, Al, Zn, और Pb की सतहें एक पतली ऑक्साइड परत से ढकी होती हैं जो उन्हें आगे की ऑक्सीकरण से रोकती हैं।
- Fe गर्म करने पर नहीं जलता, लेकिन लोहे के चूर्ण जलते हैं।
- Cu सामान्य परिस्थितियों में नहीं जलता, लेकिन गर्म करने पर कॉपर ऑक्साइड बना सकता है।
- Au और Ag ऑक्सीजन के साथ प्रतिक्रिया नहीं करते।
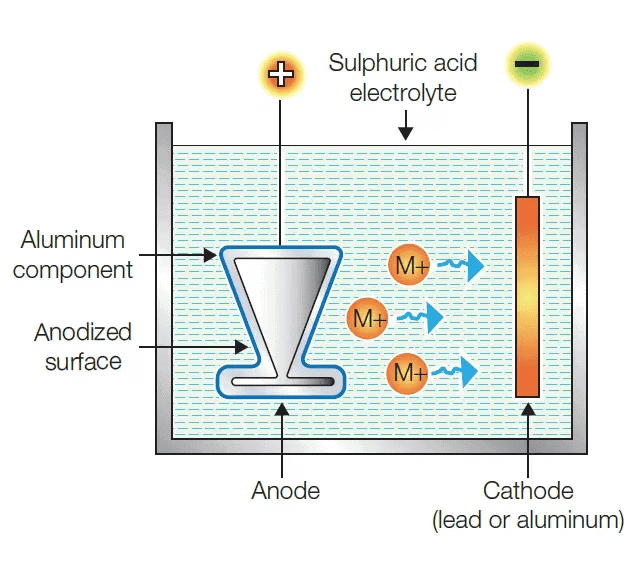
Anodising एक प्रक्रिया है जिसमें एल्यूमिनियम की मोटी ऑक्साइड परत बनाई जाती है। एल्यूमिनियम हवा के संपर्क में आने पर एक पतली ऑक्साइड परत विकसित करता है। यह एल्यूमिनियम ऑक्साइड की परत इसे आगे के क्षरण के प्रति प्रतिरोधी बनाती है। इस प्रतिरोध को और बेहतर बनाने के लिए ऑक्साइड परत को मोटी बनाया जा सकता है। Anodising के दौरान, एक साफ एल्यूमिनियम वस्तु को एनोड बनाया जाता है और इसे पतले सल्फ्यूरिक एसिड के साथ इलेक्ट्रोलाइज किया जाता है। एनोड पर विकसित होने वाला ऑक्सीजन गैस एल्यूमिनियम के साथ प्रतिक्रिया करता है जिससे एक मोटी सुरक्षात्मक ऑक्साइड परत बनती है। यह ऑक्साइड परत आसानी से रंगी जा सकती है जिससे एल्यूमिनियम वस्तुओं को आकर्षक रूप दिया जा सकता है।
Anodising प्रक्रिया
धातु ऑक्साइड प्राकृतिक रूप से आधारिक होते हैं। लेकिन कुछ धातु ऑक्साइड, जैसे कि एल्यूमिनियम ऑक्साइड, जिंक ऑक्साइड आदि, दोनों अम्ल और आधार के रूप में व्यवहार दिखाते हैं। ऐसे धातु ऑक्साइड जो दोनों अम्लों और आधारों के साथ प्रतिक्रिया करके लवण और जल उत्पन्न करते हैं, उन्हें अंपोथेरिक ऑक्साइड कहा जाता है।
(b) धातुओं की पानी के साथ प्रतिक्रिया
धातुएं पानी के साथ प्रतिक्रिया करती हैं और एक धातु ऑक्साइड और हाइड्रोजन गैस उत्पन्न करती हैं। धातु ऑक्साइड जो पानी में घुलनशील होते हैं, वे पानी में घुलकर धातु हाइड्रॉक्साइड का निर्माण करते हैं। हालांकि, सभी धातुएं पानी के साथ प्रतिक्रिया नहीं करती हैं।
- धातु + पानी → धातु ऑक्साइड + हाइड्रोजन
- धातु ऑक्साइड + पानी → धातु हाइड्रॉक्साइड
(a) पोटेशियम और सोडियम जैसी धातुएं ठंडे पानी के साथ जोरदार प्रतिक्रिया करती हैं। सोडियम और पोटेशियम के मामले में, प्रतिक्रिया इतनी जोरदार और उष্ণता उत्पन्न करने वाली होती है कि उत्पन्न हाइड्रोजन तुरंत आग पकड़ लेता है।
- 2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g) + गर्मी ऊर्जा
- 2K(s) + 2H2O(l) → 2KOH(aq) + H2(g) + गर्मी ऊर्जा
(b) कैल्शियम तैरने लगता है क्योंकि उत्पन्न हाइड्रोजन गैस के बुलबुले धातु की सतह पर चिपक जाते हैं।
- Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)
(c) मैग्नीशियम ठंडे पानी के साथ प्रतिक्रिया नहीं करता। यह गर्म पानी के साथ प्रतिक्रिया करता है और मैग्नीशियम हाइड्रॉक्साइड और हाइड्रोजन उत्पन्न करता है। यह भी हाइड्रोजन गैस के बुलबुले की सतह पर चिपकने के कारण तैरने लगता है।
- Mg(s) + 2H2O(l) → Mg(OH)2(aq) + H2(g)
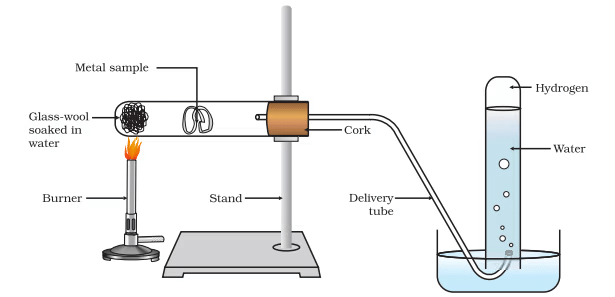
(d) एल्यूमीनियम, आयरन और जिंक जैसी धातुएं ठंडे या गर्म पानी के साथ प्रतिक्रिया नहीं करती हैं। हालाँकि, ये भाप के साथ प्रतिक्रिया करती हैं और धातु ऑक्साइड और हाइड्रोजन का निर्माण करती हैं।
- 2Al(s) + 3H2O(g) → Al2O3(s) + 3H2(g)
- 3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g)
एक धातु पर भाप का क्रिया
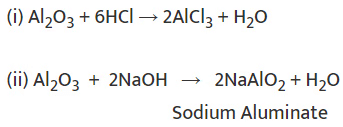
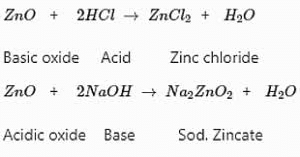
धातुएं जैसे कि सीसा (lead), तांबा (copper), चांदी (silver) और सोना (gold) पानी के साथ किसी भी प्रकार की प्रतिक्रिया नहीं करते हैं।
(c) धातुओं की प्रतिक्रियाएं एसिड (Dilute) के साथ
धातु + पतला एसिड → नमक + H2
नोट: तांबा (Cu), चांदी (Ag), और पारा (Hg) पतले एसिड के साथ प्रतिक्रिया नहीं करते हैं।
उदाहरण:
- (i) Fe + 2HCl → FeCl2 + H2
- (ii) Mg + 2HCl → MgCl2 + H2
- (iii) Zn + 2HCl → ZnCl2 + H2
- (iv) 2Al + 6HCl → 2AlCl3 + 3H2
अपवाद: - हाइड्रोजन गैस तब उत्पन्न नहीं होती जब कोई धातु नाइट्रिक एसिड (HNO3) के साथ प्रतिक्रिया करती है। इसका कारण यह है कि HNO3 एक मजबूत ऑक्सीडाइजिंग एजेंट है। यह उत्पादित H2 को पानी में ऑक्सीडाइज करता है और स्वयं किसी नाइट्रोजन ऑक्साइड (N2O, NO, NO2) में कम हो जाता है। लेकिन मैग्नीशियम (Mg) और मैंगनीज (Mn) बहुत पतले HNO3 के साथ प्रतिक्रिया करके H2 गैस उत्पन्न करते हैं।
और तांबा (Cu) HCl के साथ प्रतिक्रिया नहीं करता है।
Aqua Regia (लैटिन में 'रॉयल वाटर') एक ताजा तैयार मिश्रण है जिसमें केन्द्रित हाइड्रोक्लोरिक एसिड और केन्द्रित नाइट्रिक एसिड का अनुपात 3:1 होता है। यह सोने को घोल सकता है, हालांकि इनमें से कोई भी एसिड अकेले ऐसा नहीं कर सकता। Aqua Regia एक अत्यधिक संक्षारक, धुआंदार तरल है। यह कुछ ही रसायनों में से एक है जो सोने और प्लैटिनम को घोलने में सक्षम है।
(d) अन्य धातु के नमक के घोलों के साथ धातुओं की प्रतिक्रियाएं
धातु A + नमक घोल B → नमक घोल A + धातु B
सक्रिय धातुएं कम सक्रिय धातुओं को उनके यौगिकों से घोल के रूप में विस्थापित कर सकती हैं।
टेस्ट ट्यूब 1: Fe + CuSO4 → FeSO4 + Cu
- यहां Fe, Cu को अपने नमक घोल से विस्थापित करता है क्योंकि Fe, Cu से अधिक सक्रिय है।
टेस्ट ट्यूब 2: Cu + FeSO4 → कोई प्रतिक्रिया नहीं।

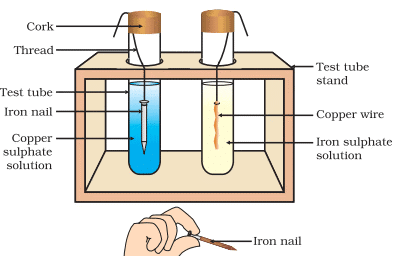
Cu Fe को अपने नमक समाधान से विस्थापित नहीं कर सकता है क्योंकि Cu, Fe से कम प्रतिक्रियाशील है।
- Cu Fe को अपने नमक समाधान से विस्थापित नहीं कर सकता है क्योंकि Cu, Fe से कम प्रतिक्रियाशील है।
(e) प्रतिक्रियाशीलता श्रृंखला
प्रतिक्रियाशीलता श्रृंखला धातुओं की एक सूची है जो उनकी घटती गतिविधियों के क्रम में व्यवस्थित होती है।
याद रखने के लिए संक्षिप्ताक्षर:- प्रसिद्ध वैज्ञानिक चिड़ियाघर में अधिक सटीकता के साथ कम आर्द्र जलवायु में बना सकते हैं।
Po:- पोटेशियम (K), S:- सोडियम (Na), Ca:- कैल्शियम (Ca), A:- एल्युमिनियम (Al), Z:- जस्ता (Zn), I:- लोहे (Fe), L:- सीसे (Pb), H:- हाइड्रोजन (H), C:- तांबा (Cu), M:- पारा (Hg), A:- चांदी (Ag)

धातुएं और अधातुएं कैसे प्रतिक्रिया करती हैं?
धातुएं और अधातुएं कैसे प्रतिक्रिया करती हैं?
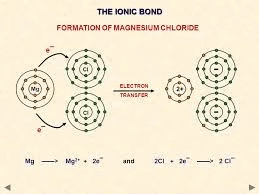
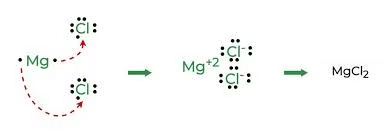
तत्वों की प्रतिक्रियाशीलता भरे हुए वैलेन्स शेल को प्राप्त करने की प्रवृत्ति है। धातुओं के परमाणु अपने वैलेन्स शेल से इलेक्ट्रॉन खोकर कैटायन बनाते हैं। अधातुओं के परमाणु वैलेन्स शेल में इलेक्ट्रॉन प्राप्त करके एनायन बनाते हैं।
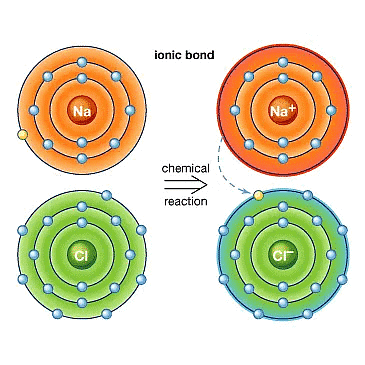
उदाहरण: NaCl का निर्माण
सोडियम (Na)
- एक सोडियम परमाणु के बाहरी शेल में एक इलेक्ट्रॉन होता है। जब यह इलेक्ट्रॉन खोता है, तो इसका अगला शेल (L शेल) बाहरी शेल बन जाता है और इसमें आठ इलेक्ट्रॉनों का पूरा सेट होता है, जिससे यह स्थिर हो जाता है। चूंकि अब इसमें 10 इलेक्ट्रॉन हैं लेकिन अभी भी 11 प्रोटॉन हैं, यह सकारात्मक चार्ज हो जाता है और इसे सोडियम आयन (Na⁺) कहा जाता है।
क्लोरीन (Cl)
- दूसरी ओर, इसके बाहरी शेल में सात इलेक्ट्रॉन होते हैं और इसे आठ इलेक्ट्रॉनों का सेट पूरा करने के लिए एक और इलेक्ट्रॉन की आवश्यकता होती है। जब सोडियम और क्लोरीन प्रतिक्रिया करते हैं, तो सोडियम परमाणु अपने अतिरिक्त इलेक्ट्रॉन को क्लोरीन को देता है। सोडियम से इलेक्ट्रॉन प्राप्त करने के बाद, क्लोरीन, जिसे मूल रूप से 17 इलेक्ट्रॉन थे, अब 18 इलेक्ट्रॉन है लेकिन अभी भी 17 प्रोटॉन हैं, जिससे यह नकारात्मक चार्ज हो जाता है। इसका परिणाम एक क्लोराइड आयन (Cl⁻) होता है। इसलिए, सोडियम और क्लोरीन मिलकर काम करते हैं, सोडियम एक इलेक्ट्रॉन देता है और क्लोरीन उसे स्वीकार करता है।
सोडियम कैटायन क्लोराइड एनायन
सोडियम और क्लोराइड आयन, जिनके चार्ज विपरीत होते हैं, एक-दूसरे को आकर्षित करते हैं और इलेक्ट्रोस्टैटिक बलों के कारण सोडियम क्लोराइड (NaCl) के रूप में एकत्र होते हैं। यह ध्यान देना चाहिए कि सोडियम क्लोराइड अणुओं के रूप में नहीं बल्कि विपरीत चार्ज वाले आयनों के समूह के रूप में विद्यमान होता है।
आयनिक यौगिक
वे यौगिक जो एक धातु से एक गैर-धातु में इलेक्ट्रॉनों के हस्तांतरण द्वारा बनते हैं, उन्हें आयनिक यौगिक या इलेक्ट्रोवैलेंट यौगिक कहा जाता है।
आयनिक यौगिकों का निर्माण
आयनिक यौगिकों के गुण
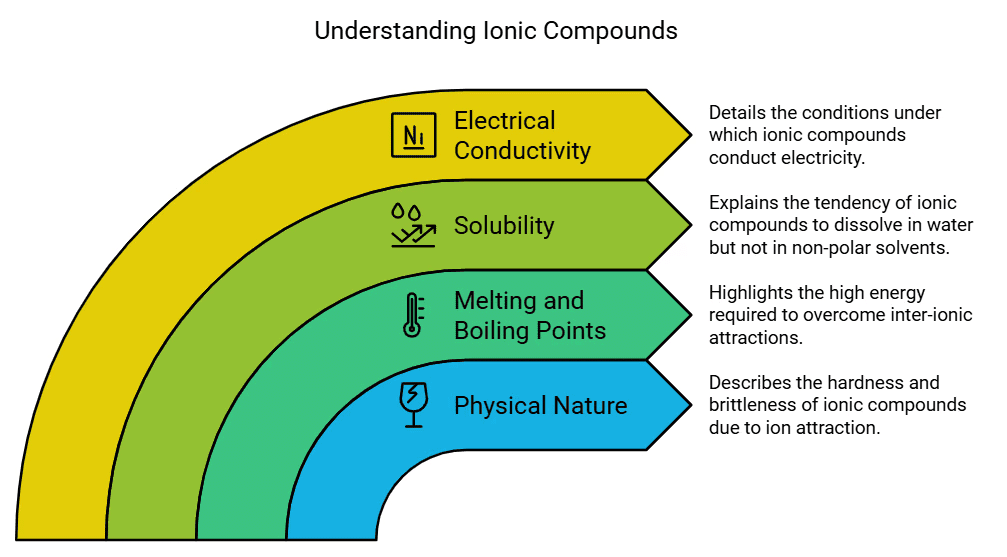
- भौतिक स्वभाव: आयनिक यौगिक ठोस पदार्थ होते हैं और सकारात्मक और नकारात्मक चार्ज वाले आयनों के बीच शक्तिशाली आकर्षण के कारण इनमें एक निश्चित स्तर की कठोरता होती है। आमतौर पर, ये यौगिक भंगुर होते हैं और दबाव के तहत टुकड़ों में टूटने की प्रवृत्ति रखते हैं।
- पिघलने और उबालने का बिंदु: आयनिक यौगिक उच्च पिघलने और उबालने के बिंदु का प्रदर्शन करते हैं क्योंकि इसमें मजबूत अंतःआयनिक आकर्षण होते हैं, जिन्हें पार करने के लिए महत्वपूर्ण मात्रा में ऊर्जा की आवश्यकता होती है।
- घुलनशीलता: इलेक्ट्रोवैलेंट यौगिक आमतौर पर पानी में घुल जाते हैं लेकिन केरोसिन या पेट्रोल जैसे सॉल्वेंट में नहीं घुलते।
- बिजली का संचालन: जब एक आयनिक यौगिक पानी में घुलता है, तो परिणामी घोल में ऐसे आयन होते हैं जो विद्युत धारा लगाए जाने पर इलेक्ट्रोड की ओर बढ़ सकते हैं। इसके विपरीत, ठोस आयनिक यौगिक बिजली का संचालन नहीं करते हैं क्योंकि आयन अपनी निश्चित व्यवस्था के कारण नहीं चल सकते। हालांकि, जब आयनिक यौगिक पिघले हुए अवस्था में होते हैं, तो वे बिजली का संचालन कर सकते हैं क्योंकि तापमान इलेक्ट्रोस्टैटिक बलों को पार कर देता है जो विपरीत चार्ज वाले आयनों को एक साथ रखते हैं। परिणामस्वरूप, आयन गतिशील हो जाते हैं और स्वतंत्र रूप से चल सकते हैं, जिससे बिजली का संचालन सुगम होता है।
धातुओं की उपस्थिति
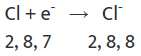
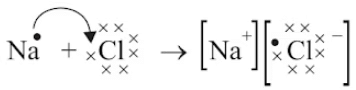
- खनिज: वे तत्व या यौगिक जो पृथ्वी की सतह में स्वाभाविक रूप से पाए जाते हैं, उन्हें खनिज कहा जाता है।
- अयस्क: खनिज जो किसी विशेष धातु का बहुत उच्च प्रतिशत रखते हैं और जिनसे धातु को लाभकारी रूप से निकाला जा सकता है, ऐसे खनिजों को अयस्क कहा जाता है।
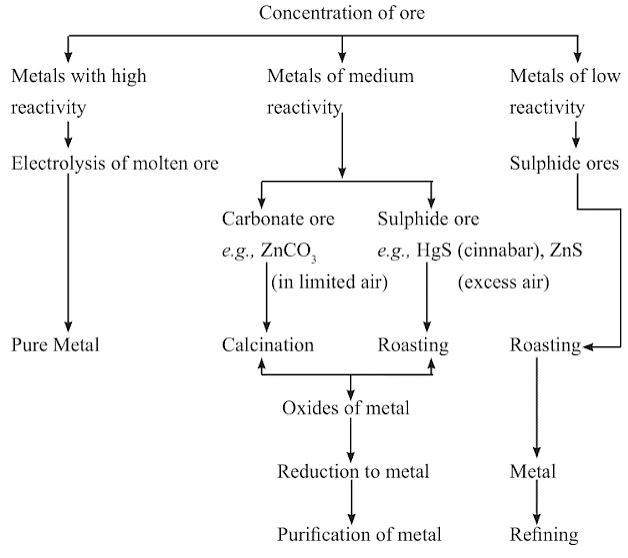
धातुओं का अयस्कों से निष्कर्षण
चरण 1: अयस्कों का समृद्धिकरण।
चरण 2: धातुओं का निष्कर्षण।
चरण 3: धातुओं का शुद्धिकरण।
चरण 1: अयस्कों का समृद्धिकरण
अयस्कों का समृद्धिकरण उन प्रक्रियाओं को संदर्भित करता है जिनमें खनन किए गए अयस्कों से मिट्टी, रेत, पत्थर और सिलिकेट जैसे अशुद्धियों को हटाया जाता है। अयस्कों में आमतौर पर अवांछित पदार्थों का एक विविधता होती है जिसे गैंग कहा जाता है। समृद्धिकरण का प्राथमिक उद्देश्य इन अशुद्धियों को अयस्कों से अलग करना है। समृद्धिकरण की विधियाँ अयस्कों के भौतिक और रासायनिक गुणों पर निर्भर करती हैं। ऐसे प्रक्रियाओं के उदाहरणों में गुरुत्वाकर्षण पृथक्करण, विद्युतचुंबकीय पृथक्करण, और फ्रोथ फ्लोटेशन शामिल हैं।
चरण 2: (i) गतिशीलता श्रृंखला में कम सक्रियता वाले धातुओं का निष्कर्षण
स्वयं-अपघटन के दौरान, जब Hg, Pb, Cu आदि जैसे धातुओं के सल्फाइड अयस्कों को हवा की उपस्थिति में गर्म किया जाता है, तो अयस्क का एक भाग ऑक्साइड में परिवर्तित हो जाता है। यह ऑक्साइड फिर शेष सल्फाइड अयस्क के साथ प्रतिक्रिया करके कच्ची धातु और सल्फर डाइऑक्साइड का उत्पादन करता है। ध्यान देने योग्य बात यह है कि इस प्रक्रिया में कोई बाहरी अपघटन एजेंट का उपयोग नहीं किया जाता है।
- 2HgS (Cinnabar) + 3O2(g) → 2HgO (कच्ची धातु) + 2SO2(g)
- 2HgO(s) + heat → 2Hg(l) + O2(g)
- Cu2S (Copper pyrite) + 3O2(g) + heat → 2Cu2O(s) + 2SO2(g)
- 2Cu2O(s) + Cu2S(s) + heat → 6Cu (कच्ची धातु) + SO2(g)
- 2PbS (Galena) + 3O2(g) + heat → 2PbO(s) + 2SO2(g)
- PbS(s) + 2PbO(s) → 2Pb (कच्ची धातु) + SO2(g)
(ii) गतिशीलता श्रृंखला में मध्य में स्थित धातुओं का निष्कर्षण
गतिविधि श्रृंखला के मध्य में स्थित धातुओं, जैसे कि आयरन, जिंक, लीड, और कॉपर, की प्रतिक्रियाशीलता का स्तर मध्यम होता है। ये धातुएं सामान्यतः प्रकृति में सल्फाइड्स या कार्बोनेट्स के रूप में पाई जाती हैं। इन धातुओं को उनके ऑक्साइड्स से प्राप्त करना सल्फाइड्स और कार्बोनेट्स से निकालने की तुलना में आसान है।
- इसलिए, कमीकरण प्रक्रिया से पहले, सल्फाइड अयस्कों और कार्बोनेट अयस्कों को धातु ऑक्साइड्स में परिवर्तित किया जाना आवश्यक है।
- सल्फाइड अयस्कों को हवा की अधिकता में तीव्र ताप द्वारा ऑक्साइड में परिवर्तित किया जाता है, जिसे रोस्टिंग कहा जाता है।
2ZnS(s) + 3O2 (g) → 2ZnO(s) + 2SO (g)
- कार्बोनेट अयस्कों को सीमित हवा के वातावरण में मजबूत ताप द्वारा ऑक्साइड में परिवर्तित किया जाता है, जिसे कैल्सिनेशन कहा जाता है।
ZnCO3 (s) → ZnO(s) + CO (g)
- फिर, धातु ऑक्साइड्स को उपयुक्त कमी करने वाले एजेंटों जैसे कि कार्बन का उपयोग करके संबंधित धातुओं में परिवर्तित किया जाता है। उदाहरण के लिए, जब जिंक ऑक्साइड को कार्बन के साथ गर्म किया जाता है, तो इसे धात्विक जिंक में परिवर्तित किया जाता है।
ZnO(s) + C(s) → Zn(s) + CO(g)
धातु ऑक्साइड्स को धातुओं में परिवर्तित करने के लिए कार्बन (कोक) का उपयोग करने के अलावा, कभी-कभी स्थानांतरण प्रतिक्रियाएँ भी उपयोग की जाती हैं। अत्यधिक प्रतिक्रियाशील धातुएं जैसे कि सोडियम, कैल्शियम, एल्यूमीनियम, आदि, को कमी करने वाले एजेंटों के रूप में उपयोग किया जाता है क्योंकि वे कम प्रतिक्रियाशील धातुओं को उनके यौगिकों से विस्थापित कर सकते हैं।
उदाहरण के लिए, जब मैंगनीज डाइऑक्साइड को एल्युमिनियम पाउडर के साथ गरम किया जाता है, तो निम्नलिखित प्रतिक्रिया होती है:
3MnO2 (s) + 4Al(s) → 3Mn(l) + 2Al2O3(s) + Heat
ये विस्थापन प्रतिक्रियाएँ अत्यधिक तापवर्धक होती हैं। उत्सर्जित गर्मी की मात्रा इतनी बड़ी होती है कि धातुएँ द्रव अवस्था में उत्पन्न होती हैं।
वास्तव में, लोहे(III) ऑक्साइड (Fe2O3) के साथ एल्युमिनियम की प्रतिक्रिया का उपयोग रेलवे पटरियों या टूटी हुई मशीन के भागों को जोड़ने के लिए किया जाता है। इस प्रतिक्रिया को थर्मिट प्रतिक्रिया कहा जाता है।
Fe2O3(s) + 2Al(s) → 2Fe(l) + Al2O3(s) + Heat
(iii) क्रियाशीलता श्रृंखला के शीर्ष की ओर धातुओं का निष्कर्षण
जो धातुएँ क्रियाशीलता श्रृंखला में उच्च स्थान पर होती हैं, वे अत्यधिक प्रतिक्रियाशील होती हैं। उन्हें कार्बन के साथ गरमी देकर उनके यौगिकों से निकाला नहीं जा सकता। उदाहरण के लिए, कार्बन जैसे सोडियम, मैग्नीशियम, कैल्शियम, और एल्युमिनियम के ऑक्साइड को शुद्ध धातुओं में प्राप्त करने के लिए कमज़ोर है।
- इसका कारण यह है कि इन धातुओं का ऑक्सीजन के प्रति आकर्षण कार्बन से अधिक मजबूत है।
- इसलिए, ये धातुएँ इलेक्ट्रोलिटिक अपघटन के माध्यम से प्राप्त की जाती हैं, जहाँ प्रक्रिया में उनके द्रव क्लोराइड का इलेक्ट्रोलाइसिस शामिल होता है।
- इस प्रक्रिया के दौरान, धातुएँ कैथोड (नकारात्मक चार्ज वाला इलेक्ट्रोड) पर जमा होती हैं, जबकि क्लोरीन गैस एनोड (सकारात्मक चार्ज वाला इलेक्ट्रोड) पर मुक्त होती है।
कैथोड (अपघटन): Na (द्रव) + e− → Na(s) धातु जमा होती है
एनोड (ऑक्सीडेशन): 2Cl− (द्रव) → Cl2(g) + 2e− क्लोरीन गैस मुक्त होती है।
महत्वपूर्ण शर्तें
(a) गैंगue: अयस्क आमतौर पर मिट्टी, रेत आदि जैसे बड़े मात्रा में अशुद्धियों से दूषित होते हैं, जिन्हें गैंगue कहा जाता है।
(b) भस्मीकरण: सल्फाइड अयस्कों को अतिरिक्त वायु की उपस्थिति में गरम करके ऑक्साइड में परिवर्तित किया जाता है। इस प्रक्रिया को भस्मीकरण कहा जाता है।
2ZnS + 3O2 → (Heat) 2ZnO + 2SO2
(c) कैल्सिनेशन: कार्बोनेट अयस्कों को सीमित वायु में गरम करके ऑक्साइड में परिवर्तित किया जाता है। इस प्रक्रिया को कैल्सिनेशन कहा जाता है।
ZnCO3 → (Heat) ZnO + CO2
(d) अपघटन: धातु ऑक्साइडों को कार्बन जैसे अपघटन एजेंट का उपयोग करके संबंधित धातुओं में घटित किया जाता है।
ZnO + C → Zn + CO
चरण 3: धातुओं का शोधन
अशुद्ध धातु को शुद्ध करने के लिए प्रयुक्त सबसे सामान्य विधि इलेक्ट्रोलिटिक शोधन है।
इलेक्ट्रोलिटिक शोधन
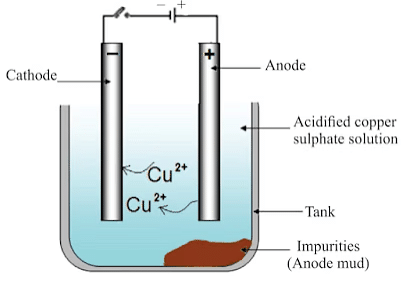
(i) एनोड: अशुद्ध तांबा (ii) कैथोड: शुद्ध तांबे की पट्टी (iii) इलेक्ट्रोलाइट: अम्लित तांबा सल्फेट का घोल
- इलेक्ट्रोलाइट के माध्यम से करंट प्रवाहित करने पर, एनोड से अशुद्ध धातु इलेक्ट्रोलाइट में घुल जाती है। इलेक्ट्रोलाइट से एक समान मात्रा में शुद्ध धातु कैथोड पर जमा हो जाती है। अघुलनशील अशुद्धताएं एनोड के नीचे बैठ जाती हैं और इन्हें एनोड की कीचड़ कहा जाता है।
क्षय
कुछ धातुओं की सतहें लंबे समय तक नम वायु के संपर्क में आने पर क्षय हो जाती हैं। इसे क्षय कहा जाता है।
क्षय के उदाहरण: (i) चांदी हवा के संपर्क में आने पर काली हो जाती है क्योंकि यह हवा के साथ प्रतिक्रिया करके चांदी सल्फाइड की परत बनाती है। (ii) तांबा हवा में नम कार्बन डाइऑक्साइड के साथ प्रतिक्रिया करता है और तांबा कार्बोनेट की हरी परत प्राप्त करता है। (iii) लोहे को नम वायु के संपर्क में आने पर जंग नामक भूरे रंग की परत प्राप्त होती है।

क्षय की रोकथाम
- लोहे की जंग को रोकने के लिए इसे रंगने, तेल देने, चिकनाई देने, गैल्वनाइजिंग, क्रोम प्लेटिंग, एनोडाइजिंग या धातु मिश्रण के द्वारा सुरक्षित किया जा सकता है। गैल्वनाइजेशन: यह एक विधि है जिसमें स्टील और लोहे को जंग से बचाने के लिए उन्हें जस्ता की एक पतली परत से कोट किया जाता है। धातु मिश्रण: धातु मिश्रण एक उपयोगी तकनीक है जिससे धातुओं के गुणों को बढ़ाया जा सकता है। एक धातु को अन्य पदार्थों के साथ मिलाकर, हम इच्छित विशेषताएँ प्राप्त कर सकते हैं।
उदाहरण के लिए, लोहे का सामान्य उपयोग होता है लेकिन इसे शुद्ध रूप में नहीं क्योंकि शुद्ध लोहे बहुत नरम होता है और गर्म करने पर आसानी से खिंचता है। हालांकि, जब लोहे को थोड़ी मात्रा में कार्बन (लगभग 0.05%) के साथ मिलाया जाता है, तो यह बहुत कठिन और मजबूत हो जाता है। इसके अलावा, लोहे को निकेल और क्रोमियम के साथ मिलाने पर स्टेनलेस स्टील प्राप्त होता है, जो दोनों कठोर और जंग के प्रति प्रतिरोधी होता है।
वास्तव में, धातु मिश्रण (alloying) आधार धातु के गुणों को बदलता है। एक मिश्र धातु (alloy) दो या दो से अधिक धातुओं, या एक धातु और एक गैर-धातु का एक समान मिश्रण है। मिश्र धातु बनाने के लिए, मुख्य धातु को पिघलाया जाता है, और अन्य तत्वों को विशेष अनुपात में जोड़ा जाता है। इसके बाद मिश्रण को ठंडा किया जाता है ताकि मिश्र धातु ठोस हो सके।
मिश्र धातुओं के उदाहरण:

- (i) लोहा: थोड़ी मात्रा में कार्बन के साथ मिलाकर यह कठोर और मजबूत बनता है।
- (ii) स्टील: लोहा, निकेल और क्रोमियम।
- (iii) पीतल: तांबा और जस्ता।
- (iv) कांस्य: तांबा और टिन (Sn)।
- (v) सोल्डर: सीसा और टिन।
- (vi) अमलगम: यदि इनमें से कोई धातु पारा (Hg) हो।
सामान्यतः मिश्र धातुओं की बिजली की चालकता और पिघलने के बिंदु शुद्ध धातुओं की तुलना में कम होती है। उदाहरण के लिए, पीतल, जो कि तांबा और जस्ता (Cu और Zn) की एक मिश्र धातु है, और कांस्य, जो कि तांबा और टिन (Cu और Sn) की एक मिश्र धातु है, शुद्ध तांबे की तरह बिजली का अच्छा संचालन नहीं करते हैं, जो सामान्यतः इलेक्ट्रिकल सर्किट में उपयोग किया जाता है। इसी तरह, सोल्डर, जो कि सीसा और टिन (Pb और Sn) की एक मिश्र धातु है, का पिघलने का बिंदु कम होता है और इसे इलेक्ट्रिकल तारों को जोड़ने के लिए उपयोग किया जाता है।
शुद्ध सोना, जिसे 24 कैरेट सोना कहा जाता है, बहुत लचीला और नरम होता है। इसलिए, यह गहनों के निर्माण के लिए उपयुक्त नहीं है। इसे कठोर बनाने के लिए इसे या तो चांदी या तांबे के साथ मिश्रित किया जाता है। सामान्यतः, भारत में, 22 कैरेट सोने का उपयोग आभूषण बनाने के लिए किया जाता है। इसका मतलब है कि 22 भाग शुद्ध सोने को 2 भाग या तो तांबे या चांदी के साथ मिश्रित किया जाता है।
अक्सर पूछे जाने वाले प्रश्न (FAQs)
Q1. धातुओं के भौतिक गुण क्या हैं?
Ans. धातुएं सामान्यतः कठोर, घनी, चमकदार, लचीली, डक्टाइल और उच्च ताप और बिजली की चालक होती हैं। इनमें उच्च उबालने और पिघलने का बिंदु होता है और ये सामान्यतः कमरे के तापमान पर ठोस होती हैं।
प्रश्न 2: गैर-धातुओं की भौतिक विशेषताएँ क्या हैं? उत्तर: गैर-धातुएँ आमतौर पर सुस्त, भंगुर, और गर्मी तथा बिजली की Poor conductors होती हैं। इनमें उच्च तापमान पर उबलने और पिघलने के बिंदु कम होते हैं और ये कमरे के तापमान पर तीनों द्रव्यमान अवस्थाओं में मौजूद हो सकती हैं। गैर-धातुएँ न तो मैलियाबल होती हैं और न ही डक्टाइल।
प्रश्न 3: धातुओं और गैर-धातुओं में क्या अंतर है? उत्तर: धातुओं और गैर-धातुओं के बीच मुख्य अंतर उनकी भौतिक विशेषताएँ हैं। धातुएँ आमतौर पर कठोर, घनी, और गर्मी तथा बिजली की अच्छे conductors होती हैं, जबकि गैर-धातुएँ भंगुर, सुस्त, और Poor conductors होती हैं। इसके अतिरिक्त, धातुएँ आमतौर पर कैटायन बनाती हैं, जबकि गैर-धातुएँ एनायन बनाती हैं।
प्रश्न 4: धातुओं के कुछ सामान्य उपयोग क्या हैं? उत्तर: धातुओं के विभिन्न उपयोग होते हैं, जैसे कि निर्माण, परिवहन, इलेक्ट्रिकल वायरिंग, और उपकरणों तथा मशीनों के उत्पादन में। कुछ धातुएँ, जैसे कि सोना और चाँदी, आभूषण और मुद्रा में उपयोग की जाती हैं। लोहे और स्टील का सामान्यतः निर्माण और विनिर्माण में उपयोग होता है।
प्रश्न 5: गैर-धातुओं के कुछ सामान्य उपयोग क्या हैं? उत्तर: गैर-धातुओं का उपयोग विभिन्न अनुप्रयोगों में होता है, जैसे कि प्लास्टिक, सिरेमिक, और सेमीकंडक्टर्स के उत्पादन में। गैर-धातुएँ, जैसे कि ऑक्सीजन और नाइट्रोजन, जीवन के लिए आवश्यक हैं और वायुमंडल में मौजूद हैं। गैर-धातुएँ, जैसे कि सल्फर और क्लोरीन, विभिन्न रसायनों के उत्पादन में उपयोग की जाती हैं।
|
1 videos|326 docs|212 tests
|















