एनसीईआरटी सारांश: कार्बन और इसके यौगिक | विज्ञान और प्रौद्योगिकी (Science & Technology) for UPSC CSE PDF Download
कार्बन एक अत्यंत महत्वपूर्ण तत्व है जो हमारे द्वारा हर दिन उपयोग की जाने वाली कई चीज़ों में पाया जाता है, जैसे कि खाना, कपड़े, दवाइयाँ, और किताबें। हालांकि पृथ्वी की पपड़ी में कार्बन की मात्रा बहुत कम है (0.02%) और वायुमंडल में (0.03% कार्बन डाइऑक्साइड के रूप में), फिर भी यह हमारे जीवन में एक महत्वपूर्ण भूमिका निभाता है। यह अध्याय यह बताएगा कि कार्बन इतना महत्वपूर्ण क्यों है और यह क्यों खास है।

1. कार्बन में बंधन - कोवेलेंट बंधन
कार्बन यौगिक वे पदार्थ हैं जो मुख्य रूप से कार्बन परमाणुओं से बने होते हैं जो अन्य तत्वों के साथ जुड़े होते हैं। ये यौगिक विशिष्ट गुण प्रदर्शित करते हैं जो उन्हें अन्य प्रकार के यौगिकों से अलग करते हैं।
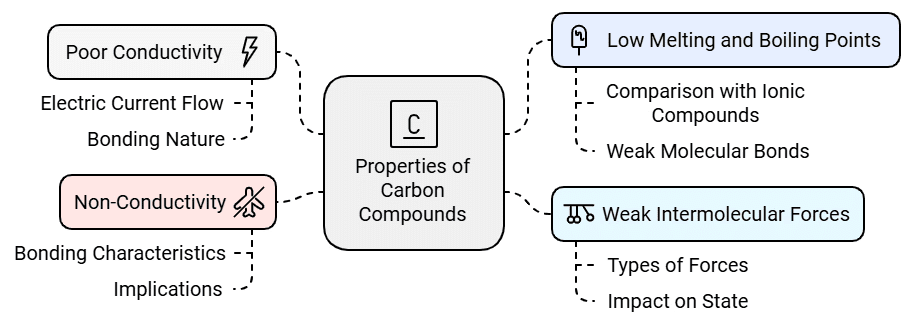
कार्बन यौगिकों के गुण:
- कम चालकता: अधिकांश कार्बन यौगिक अच्छी तरह से बिजली का संचालन नहीं करते हैं। इसका मतलब है कि वे आसानी से इलेक्ट्रिक करंट को बहने नहीं देते।
- कम पिघलने और उबालने के बिंदु: कार्बन यौगिकों की तुलना में आयनिक यौगिकों के पिघलने और उबालने के बिंदु आमतौर पर कम होते हैं। यह इंगित करता है कि अणुओं को एक साथ रखने वाली शक्तियाँ अपेक्षाकृत कमजोर हैं।
- कमज़ोर अंतःआण्विक बल: कार्बन यौगिकों में अणुओं के बीच आकर्षण की शक्तियाँ बहुत मजबूत नहीं होती हैं, जिससे उनके पिघलने और उबालने के बिंदु कम होते हैं।
- गैर-चालकता: चूंकि कार्बन यौगिक ज्यादातर बिजली के गैर-चालक होते हैं, यह सुझाव देता है कि इन यौगिकों के भीतर का बंधन आयनों के निर्माण का परिणाम नहीं देता।
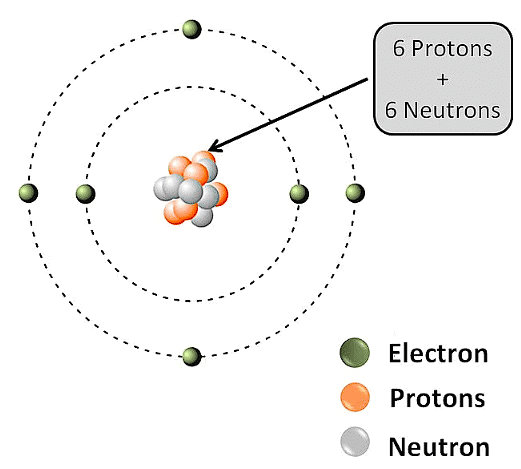
कार्बन में इलेक्ट्रॉन वितरण
कार्बन के पास 6 इलेक्ट्रॉन होते हैं। ये 2 पहले शेल में और 4 दूसरे शेल में वितरित होते हैं। कार्बन के पास 4 वैलेन्स इलेक्ट्रॉन होते हैं क्योंकि ये उसकी सबसे बाहरी शेल में होते हैं।
प्रतिक्रियाशीलता और नोबल गैस संरचना:
- तत्व एक स्थिर बाहरी शेल प्राप्त करने का प्रयास करते हैं जो नोबल गैसों के समान हो।
- कार्बन को स्थिर संरचना प्राप्त करने के लिए 4 और इलेक्ट्रॉन की आवश्यकता होती है।
नोट: कार्बन स्थिरता प्राप्त कर सकता है:
(a) इलेक्ट्रॉन प्राप्त करके:
- कार्बन 4 इलेक्ट्रॉन प्राप्त कर सकता है और C4- (ऐनियन) बन सकता है। यह चुनौतीपूर्ण होगा क्योंकि नाभिक, जिसमें 6 प्रोटॉन होते हैं, 10 इलेक्ट्रॉन को पकड़ने में संघर्ष करेगा।
(b) इलेक्ट्रॉन खोकर:
- कार्बन 4 इलेक्ट्रॉन खो सकता है और C4+ (कैशन) बन सकता है। इस प्रक्रिया में 4 इलेक्ट्रॉन निकालने के लिए बहुत सारी ऊर्जा की आवश्यकता होगी, जिससे कार्बन कैशन केवल 2 इलेक्ट्रॉन के साथ रह जाएगा।
कवैलेंट बांड क्या है?
कवैलेंट बांड तब बनते हैं जब दो परमाणु एक इलेक्ट्रॉन जोड़ी साझा करते हैं, जिससे अणुओं के भीतर मजबूत बांड बनते हैं लेकिन अंतर्विभागीय बल कमजोर होते हैं।
कवैलेंट बांड के गुण
- कवैलेंट यौगिकों के सामान्यतः कम पिघलने और उबालने के बिंदु होते हैं।
- पानी और अन्य ध्रुवीय सॉल्वेंट्स में, कवैलेंट यौगिक अक्सर अघुलनशील या कम घुलनशील होते हैं।
- इन सामग्रियों को पिघलाने या घोलने पर, ये विद्युत के Poor conductors होते हैं।
उदाहरण:
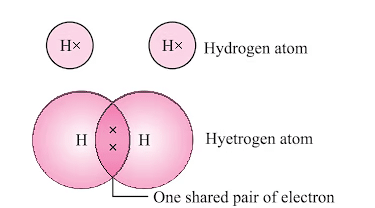
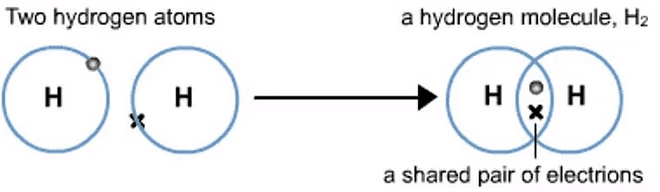
(i) हाइड्रोजन अणु (H2)
- हाइड्रोजन का परमाणु संख्या 1 है, जिसका अर्थ है कि इसके बाहरी शेल में एक इलेक्ट्रॉन है।
- अपने शेल को पूरा करने के लिए, हाइड्रोजन को एक और इलेक्ट्रॉन की आवश्यकता होती है।
- दो हाइड्रोजन परमाणु अपने इलेक्ट्रॉन को साझा करके एक हाइड्रोजन अणु (H₂) बनाते हैं।
- यह साझा करना प्रत्येक हाइड्रोजन परमाणु को हीलियम, निकटतम नoble gas के समान इलेक्ट्रॉन कॉन्फ़िगरेशन प्राप्त करने की अनुमति देता है।
(ii) ऑक्सीजन अणु (O2)
- ऑक्सीजन दो ऑक्सीजन परमाणुओं के बीच एक डबल बंधन बनाता है।
- प्रत्येक ऑक्सीजन परमाणु के बाहरी शेल में छह इलेक्ट्रॉन होते हैं और इसे भरने के लिए दो और की आवश्यकता होती है।
- अपने बाहरी शेल को पूरा करने के लिए, दो ऑक्सीजन परमाणु एक-दूसरे के साथ दो इलेक्ट्रॉन साझा करते हैं।
- यह साझा करना दो जोड़े साझा इलेक्ट्रॉनों का निर्माण करता है।
- दो साझा इलेक्ट्रॉनों के ये जोड़े ऑक्सीजन परमाणुओं के बीच एक डबल बंधन बनाते हैं।
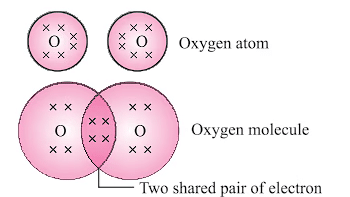
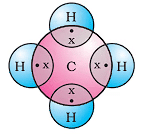
(iii) मीथेन (CH4)
- यह कार्बन द्वारा बनाए गए सबसे सरल यौगिकों में से एक है।
- मीथेन का सूत्र CH₄ है।
- हाइड्रोजन की वैलेंसी 1 है।
- कार्बन की वैलेंसी 4 है क्योंकि इसके चार बाहरी इलेक्ट्रॉन होते हैं।
- एक स्थिर इलेक्ट्रॉन व्यवस्था प्राप्त करने के लिए, कार्बन अपने चार इलेक्ट्रॉनों को चार हाइड्रोजन परमाणुओं के साथ साझा करता है।
कोवैलेंट बंधन बनाने के कई तरीके हैं।
(i) एकल कोवैलेंट बंधन: दो परमाणुओं के बीच एक इलेक्ट्रॉन जोड़े के साझा करने से बनता है।
उदाहरण: HCl (हाइड्रोक्लोरिक एसिड) में, हाइड्रोजन एक इलेक्ट्रॉन को क्लोरीन के साथ साझा करता है।
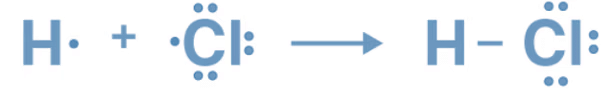
(ii) अनेक कोवैलेंट बंधन: एक से अधिक इलेक्ट्रॉन जोड़ों के साझा करने में शामिल होते हैं।
- डबल बंधन: दो इलेक्ट्रॉन जोड़े साझा करता है।
- ट्रिपल बंधन: तीन इलेक्ट्रॉन जोड़े साझा करता है।
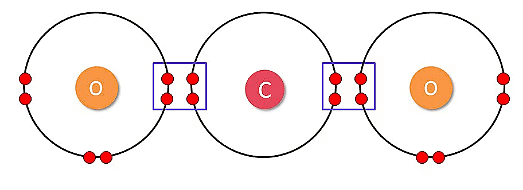
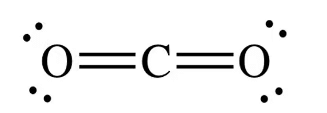
उदाहरण: CO₂ (कार्बन डाइऑक्साइड) में, कार्बन दो ऑक्सीजन परमाणुओं के साथ दो डबल बंधन बनाता है।
हाइड्रोजन, नाइट्रोजन और पानी में सहसंयोजक बंधन
अन्य तत्वों जैसे हाइड्रोजन, ऑक्सीजन, नाइट्रोजन और क्लोरीन के परमाणु भी इलेक्ट्रॉनों को साझा करके बंधन बनाते हैं।
- हाइड्रोजन ब्रह्मांड में सबसे सरल और सबसे प्रचुर तत्व है। यह एक बहुत ही बहुपरकारी तत्व है जिसमें अद्वितीय बंधन क्षमता होती है।
- हाइड्रोजन के वैलेंस शेल में केवल एक इलेक्ट्रॉन होता है, जो इसे अत्यधिक प्रतिक्रियाशील बनाता है और इसे कई अन्य तत्वों के साथ मजबूत बंधन बनाने में सक्षम बनाता है। हाइड्रोजन में बंधन का सबसे सामान्य प्रकार सहसंयोजक बंधन है, जहां यह अन्य तत्वों के साथ इलेक्ट्रॉनों को साझा करके अणु बनाता है।
- हाइड्रोजन आयनिक बंधन भी बना सकता है, जहां यह इलेक्ट्रॉनों को दान या स्वीकार करके आयन बनाता है। ये बंधन गुण हाइड्रोजन को कई रासायनिक प्रतिक्रियाओं में एक महत्वपूर्ण घटक बनाते हैं, जिसमें सूर्य और अन्य सितारों को शक्ति देने वाली प्रतिक्रियाएं भी शामिल हैं।
H-H हाइड्रोजन परमाणुओं के बीच एकल बंधन (H2)
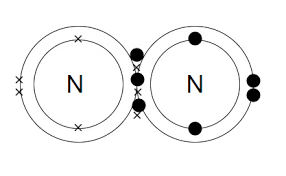
नाइट्रोजन एक महत्वपूर्ण तत्व है जो जैविक और अजैविक यौगिकों दोनों में पाया जाता है, और इसकी बंधन गुणधर्म इसकी कई अनुप्रयोगों के लिए आवश्यक हैं।
- नाइट्रोजन के बाहरी आवरण में पांच इलेक्ट्रॉन होते हैं, जो इसे संपूर्ण बंधन व्यवस्थाओं को बनाने की अनुमति देते हैं, जिनमें संवर्धित, आयनिक, और धात्विक बंधन शामिल हैं।
- संवर्धित बंधन नाइट्रोजन युक्त यौगिकों में सबसे सामान्य प्रकार का बंधन है, जहां नाइट्रोजन अन्य गैर-धातु परमाणुओं के साथ इलेक्ट्रॉन साझा करता है ताकि स्थिर अणु बनाए जा सकें।
- ये यौगिक विभिन्न अनुप्रयोगों में उपयोग होते हैं, जैसे कि उर्वरक से लेकर फार्मास्यूटिकल्स तक।
N≡N नाइट्रोजन परमाणुओं के बीच त्रैतीय बंधन
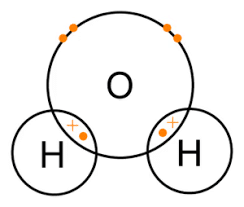
पानी एक अद्वितीय और आवश्यक यौगिक है जो पृथ्वी पर जीवन के कई पहलुओं में महत्वपूर्ण भूमिका निभाता है। पानी में बंधन एक प्रमुख कारक है जो इसे इसकी विशेष गुणधर्म प्रदान करता है।
- पानी के अणु दो हाइड्रोजन परमाणुओं से मिलकर बने होते हैं, जो एक ऑक्सीजन परमाणु के साथ संवर्धित बंधित होते हैं, जिससे एक V-आकार का अणु बनता है।
- हाइड्रोजन परमाणु ऑक्सीजन परमाणु के साथ इलेक्ट्रॉन साझा करके बंधित होते हैं, जिससे एक ध्रुवीय संवर्धित बंधन बनता है।
- इसका मतलब है कि बंधन में इलेक्ट्रॉन समान रूप से साझा नहीं होते हैं, ऑक्सीजन परमाणु इलेक्ट्रॉनों को अपने करीब खींचता है।
पानी के अणु में एक ऑक्सीजन और दो हाइड्रोजन परमाणुओं के बीच एकल संवर्धित बंधन होता है (H2O)
1.1 कार्बन के ऑलोट्रोप्स
वह गुण जिसके कारण एक तत्व दो या अधिक भौतिक रूपों में मौजूद होता है, उसे ऑलोट्रॉपी कहा जाता है।
एक तत्व के विभिन्न भौतिक रूपों को ऑलोट्रोप्स कहा जाता है।
कार्बन में विभिन्न रूपों में मौजूद होने की अनूठी विशेषता है, जैसे कि हीरा, ग्रेफाइट, कोक, कोयला, लैम्पब्लैक और गैस कार्बन। ऑलोट्रोप्स के भौतिक गुण भिन्न होते हैं (क्योंकि इनमें परमाणुओं की व्यवस्था अलग होती है, लेकिन रासायनिक गुण समान होते हैं)।
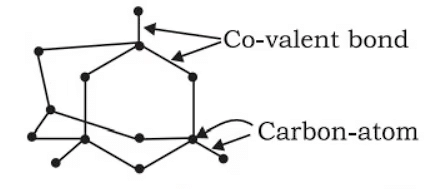
(a) हीरा - हीरे में, प्रत्येक कार्बन परमाणु चार अन्य कार्बन परमाणुओं के साथ चार एकल सहसंयोजक बंधनों द्वारा जुड़ा होता है, जिससे एक कठोर, त्रि-आयामी, घनत्वपूर्ण संरचना बनती है। इसका परिणाम यह होता है कि हीरे का घनत्व ग्रेफाइट की तुलना में अधिक होता है। सभी वैलेंस इलेक्ट्रॉनों का उपयोग बंधन में होता है, इसलिए यहां कोई फ्री इलेक्ट्रॉन नहीं होते - कोई विद्युत चालकता नहीं।
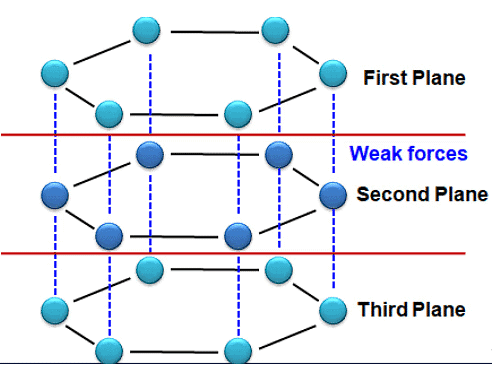
(b) ग्रेफाइट - ग्रेफाइट में, प्रत्येक कार्बन परमाणु एक ही स्तर पर तीन अन्य कार्बन परमाणुओं के साथ जुड़ा होता है, जिससे एक षट्कोणीय व्यवस्था बनती है। प्रत्येक कार्बन परमाणु पर एक इलेक्ट्रॉन स्वतंत्र होता है (जो बंधन में उपयोग नहीं होता)। इसलिए, ग्रेफाइट विद्युत का एक अच्छा चालक है। ग्रेफाइट की संरचना को परतों में रखकर बनाया गया है, जो एक दूसरे के ऊपर स्थित होती हैं और कमजोर बलों (वैन डेर वॉएल्स बल) द्वारा बंधी होती हैं, इसलिए ये परतें एक-दूसरे के ऊपर खिसक सकती हैं।
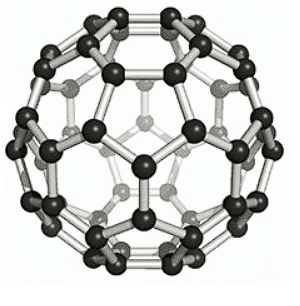
(c) फुल्लेरेन्स - सबसे पहले पहचानने वाला फुल्लेरेन C-60 था, जिसमें कार्बन परमाणु एक फुटबॉल के आकार में व्यवस्थित होते हैं। चूंकि यह अमेरिकी आर्किटेक्ट बक मिन्स्टर फुलर द्वारा डिज़ाइन किए गए ज्योमेट्रिक गुंबद के समान दिखता था, इसलिए इस अणु का नाम फुल्लेरेन रखा गया। बकी बॉल्स (C-60) का पता काली धूल में चला। ये ग्रेफाइट के समान नरम होते हैं। इसमें 20 षट्कोण और 12 पेंटागोन होते हैं। इसे 'बुल्की बॉल' का उपनाम दिया गया था।
2. कार्बन की बहुपरकारी प्रकृति
कार्बन एक अद्वितीय तत्व है जिसमें दो विशेष गुण (कैटेनशन और टेट्रावेलेंसी) होते हैं, जो कई यौगिकों के निर्माण का कारण बनते हैं।
(i) कैटेनशन: कार्बन परमाणुओं की आत्म-लिंकिंग क्षमता
- कार्बन परमाणुओं में लंबे श्रृंखलाओं या वृत्तों का निर्माण करने की अद्वितीय क्षमता होती है, जो कोवेलेंट बंधनों के माध्यम से होती है।
- यह कार्बन परमाणुओं को अन्य कार्बन परमाणुओं के साथ बंधने की अनुमति देता है, जिससे रेखीय, शाखित, या चक्रीय संरचनाएँ बनती हैं।
- कार्बन परमाणुओं के बीच मजबूत कोवेलेंट बंधन स्थिर अणुओं के निर्माण को सक्षम बनाते हैं, जिनकी रासायनिक और भौतिक गुण विविध होते हैं।
(ii) टेट्रावेलेंसी: चार वैलेंस इलेक्ट्रॉन
- कार्बन परमाणुओं में बंधन के लिए चार वैलेंस इलेक्ट्रॉन उपलब्ध होते हैं।
- यह टेट्रावेलेंसी कार्बन को हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, और सल्फर जैसे विभिन्न परमाणुओं के साथ मजबूत कोवेलेंट बंधन बनाने में सक्षम बनाती है।
- कार्बन इन परमाणुओं के साथ एकल, द्विगुण, या त्रिगुण बंधन स्थापित कर सकता है, जो उपलब्ध इलेक्ट्रॉनों की संख्या और वांछित आणविक स्थिरता पर निर्भर करता है।
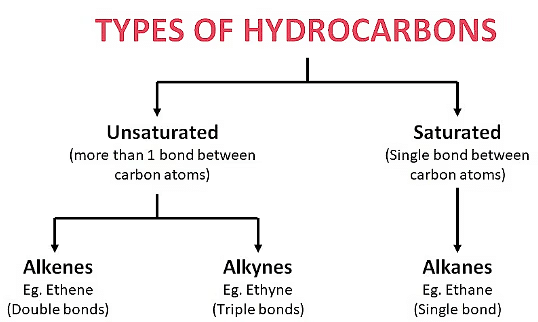
2.1 संतृप्त और असंतृप्त कार्बन यौगिक
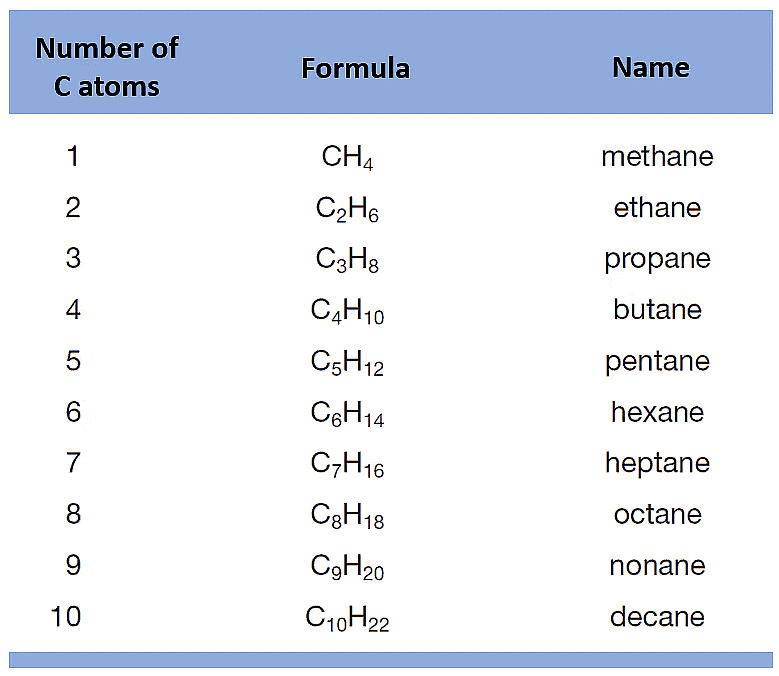
हाइड्रोजन और कार्बन से बने यौगिकों को हाइड्रोकार्बन कहा जाता है।
हाइड्रोकार्बन के दो प्रकार होते हैं।
(i) संतृप्त हाइड्रोकार्बन
संतृप्त हाइड्रोकार्बन वे हाइड्रोकार्बन होते हैं जिनमें कार्बन परमाणुओं के बीच केवल एकल बंधन होते हैं। ये हाइड्रोकार्बन का सबसे सरल वर्ग हैं।

कार्बन अणुओं के बीच एकल बंधन: ㅡCㅡCㅡ अल्केन संतृप्त हाइड्रोकार्बन हैं। सामान्य सूत्र: CnH2n + 2
- अल्केन संतृप्त हाइड्रोकार्बन हैं। सामान्य सूत्र: CnH2n + 2
उदाहरण: एथेन C2H6
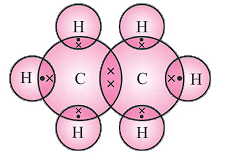
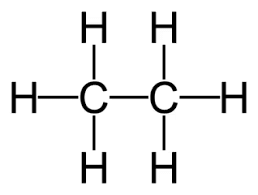
संतृप्त यौगिकों के सूत्र और संरचनाएँ
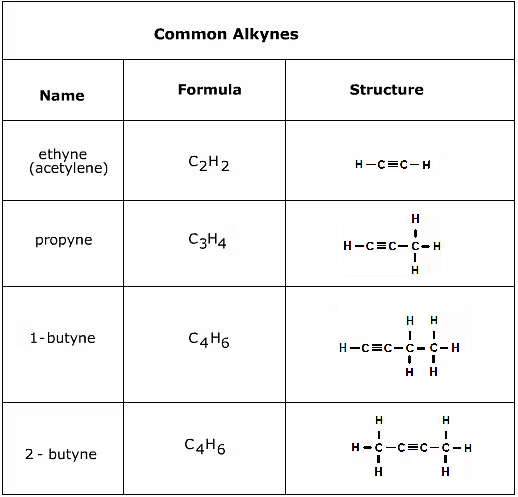
(ii) असंतृप्त हाइड्रोकार्बन
असंतृप्त हाइड्रोकार्बन में कार्बन अणुओं के बीच कम से कम एक दोहरे या तिहरे बंधन होता है। इसका मतलब है कि इनमें संतृप्त हाइड्रोकार्बनों की तुलना में कम हाइड्रोजन अणु होते हैं, जिनमें केवल कार्बन अणुओं के बीच एकल बंधन होते हैं।
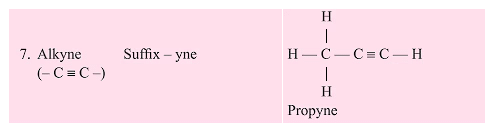
- कार्बन अणुओं के बीच दोहरा या तिहरा बंधन। अल्कीन और एल्काइन असंतृप्त हाइड्रोकार्बन हैं।
- अल्कीन: ㅡC=Cㅡ (सामान्य सूत्र: CnH2n)
- एल्काइन: ㅡC≡Cㅡ (सामान्य सूत्र: CnH2n-2)
उदाहरण: एथीन एवं एथाइन
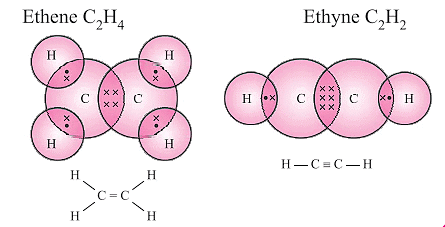
असंतृप्त यौगिकों के सूत्र और संरचनाएँ
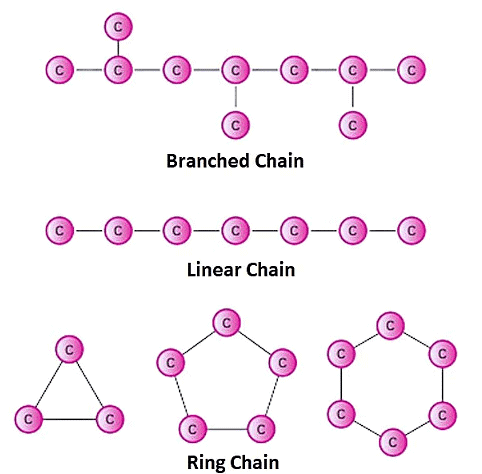
2.2 श्रंखलाएँ, शाखाएँ, और रिंग्स
कार्बन अणु विभिन्न संरचनाएँ बना सकते हैं, जो अणुओं के गुणों को महत्वपूर्ण रूप से प्रभावित करती हैं। ये संरचनाएँ सीधे श्रंखलाएँ, शाखित श्रंखलाएँ, और रिंग्स शामिल हैं।
(i) सीधी (अनशाखित) श्रंखला
इनमें कार्बन अणुओं की रैखिक व्यवस्था होती है, जो एकल सहसंयोजक बंधनों के साथ जुड़ी होती है।
उदाहरण: C3H8
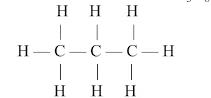
(ii) शाखित संरचना
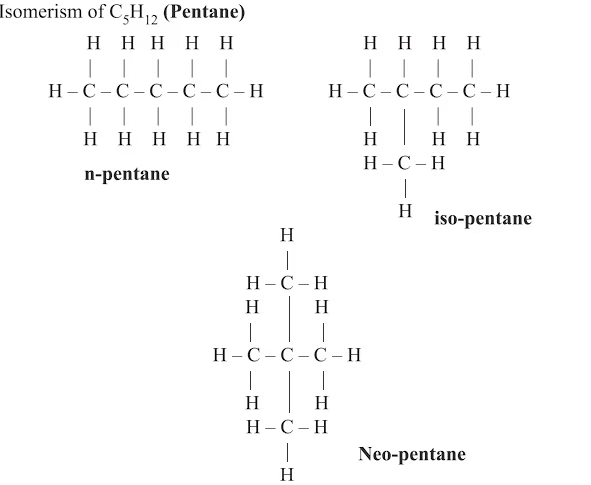
उपरोक्त तीन यौगिकों का समान आणविक सूत्र है लेकिन भिन्न संरचनाएँ हैं, जिन्हें संरचनात्मक समागामी कहते हैं और इस घटना को संरचनात्मक समागम कहते हैं।
उदाहरण: पेंटेन (C5H12)
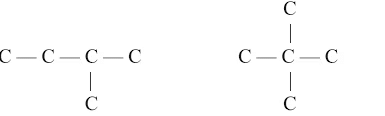
नोट: समागामी - यौगिक जिनका समान आणविक सूत्र है लेकिन भिन्न संरचनाएँ हैं।
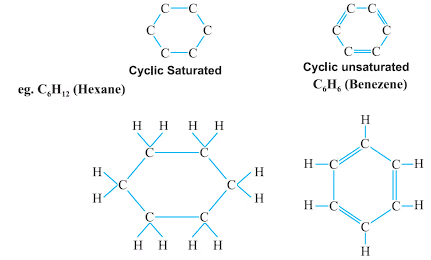
(iii) चक्रीय संरचना
चक्रीय हाइड्रोकार्बन, जिन्हें चक्रीय यौगिक भी कहा जाता है, वे कार्बनिक अणु होते हैं जिनमें कार्बन परमाणु एक रिंग संरचना में व्यवस्थित होते हैं।
2.3 क्या आप मेरे मित्र बनेंगे
कार्बन एक बहुपरकारी तत्व है जो अन्य विभिन्न तत्वों जैसे कि हैलोज़, ऑक्सीजन, नाइट्रोजन, और सल्फर के साथ बंधन बना सकता है, इसके अलावा हाइड्रोजन के। जब ये तत्व हाइड्रोजन को हाइड्रोकार्बन की श्रृंखला में प्रतिस्थापित करते हैं, तो इन्हें हेटेरोएटम कहा जाता है।
- ये हेटेरोएटम, जो विशिष्ट समूहों में पाए जाते हैं, यौगिकों को अनोखे गुण प्रदान करते हैं, जिन्हें कार्यात्मक समूह कहा जाता है।
- कार्यात्मक समूह महत्वपूर्ण होते हैं क्योंकि ये एक यौगिक की विशेषताओं को निर्धारित करते हैं, चाहे वे किसी भी प्रकार की या लंबाई की कार्बन श्रृंखला से जुड़े हों।
- ये हेटेरोएटम या परमाणुओं का समूह जो कार्बन यौगिक को प्रतिक्रियाशील बनाता है और उनके गुणों का निर्धारण करता है, कार्यात्मक समूह कहलाता है।
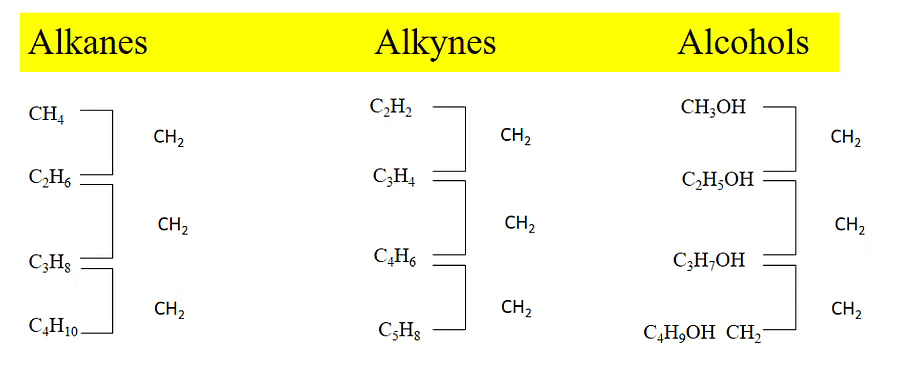
2.4 समरूप श्रृंखला
वे कार्बनिक यौगिक जो समान सामान्य आणविक सूत्र, समान संरचना और समान रासायनिक गुण रखते हैं, उन्हें समरूप (Homolog) कहा जाता है, और ऐसे समान यौगिकों की श्रृंखला को समरूप श्रृंखला कहा जाता है।
समरूप श्रृंखला की विशेषताएँ
- समरूप श्रृंखला के सभी सदस्यों का समान सामान्य आणविक सूत्र होता है।
- समरूप श्रृंखला के किसी दो आसन्न सदस्यों के बीच आणविक सूत्र में अंतर CH2 होता है।
- समरूप श्रृंखला के किसी भी सदस्य की तैयारी की विधियाँ और रासायनिक गुण समान होते हैं।
- समरूप श्रृंखला में शारीरिक गुण जैसे कि पिघलने का बिंदु और उबालने का बिंदु श्रृंखला के नीचे जाते समय क्रमिक रूप से बदलते हैं।
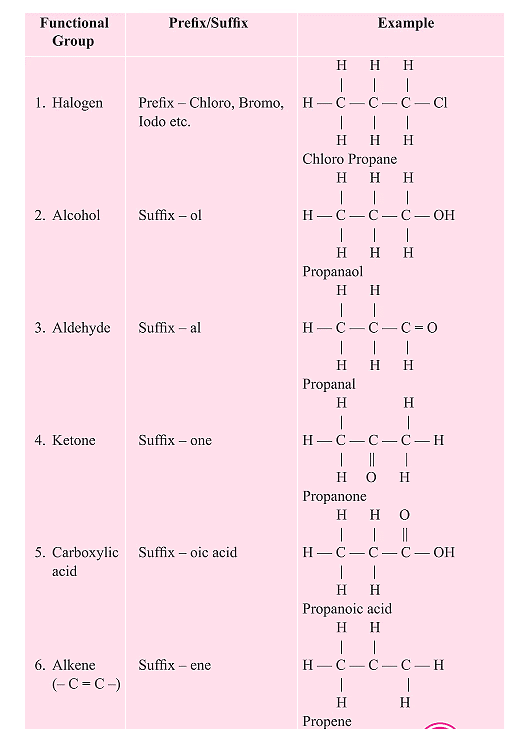
2.5 कार्बन यौगिकों की नामकरण
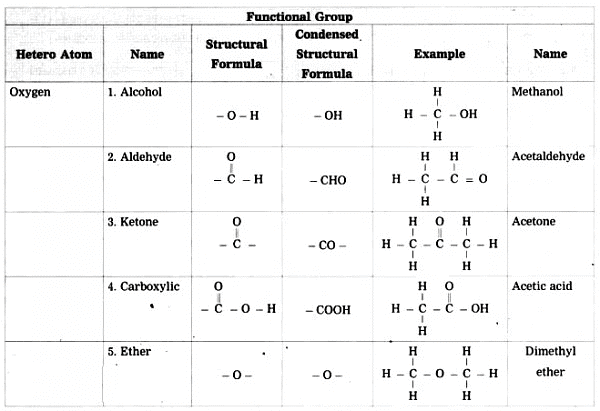
जब किसी कार्बन यौगिक का नामकरण किया जाता है, तो यौगिक में कार्बन परमाणुओं की संख्या को पहचाना जाता है और मूल कार्बन श्रृंखला के नाम को एक उपसर्ग या प्रत्यय द्वारा संशोधित किया जाता है, जो यौगिक में उपस्थित कार्यात्मक समूह के स्वभाव को दर्शाता है।
- कार्यात्मक समूह को उपसर्ग या प्रत्यय द्वारा दर्शाया जा सकता है। यदि कार्यात्मक समूह का प्रत्यय स्वर से शुरू होता है, जैसे कि a, e, i, o, u, तो कार्बन श्रृंखला के नाम में अंतिम 'e' को हटा दिया जाता है और उपयुक्त प्रत्यय जोड़ा जाता है। उदाहरण के लिए, तीन कार्बन श्रृंखला जिसमें एक केटोन समूह हो, उसे प्रोपैनोन कहा जाएगा।
- यदि कार्बन श्रृंखला असंतृप्त है, तो कार्बन श्रृंखला के नाम में अंतिम 'ane' को 'ene' या 'yne' से बदल दिया जाता है।
- एक होमोलोगस श्रृंखला में यौगिकों के नाम मूल कार्बन श्रृंखला के नाम पर आधारित होते हैं, जिसे कार्यात्मक समूह के स्वभाव को दर्शाने वाले उपसर्ग या प्रत्यय द्वारा संशोधित किया जाता है।
3. कार्बन यौगिकों के रासायनिक गुण
3.1 दहन
- कार्बन और इसके यौगिकों का उपयोग ईंधन के रूप में किया जाता है क्योंकि ये हवा में जलते हैं और बहुत सारी गर्मी ऊर्जा छोड़ते हैं।
- संतृप्त हाइड्रोकार्बन आमतौर पर हवा में नीली और बिना कालिख वाली लौ के साथ जलते हैं।
- असंतृप्त हाइड्रोकार्बन हवा में पीली कालिख वाली लौ के साथ जलते हैं क्योंकि इनमें कार्बन की मात्रा संतृप्त हाइड्रोकार्बन की तुलना में अधिक होती है, जो हवा में पूरी तरह से ऑक्सीकृत नहीं होती।
- C O2 → CO2 गर्मी और प्रकाश
- CH4 O2 → CO2 H2O गर्मी और प्रकाश
- CH3CH2OH O2 → CO2 H2O गर्मी और प्रकाश
3.2 ऑक्सीकरण
कार्बन यौगिकों में ऑक्सीकरण से तात्पर्य एक रासायनिक प्रतिक्रिया से है जिसमें कार्बन यौगिक से ऑक्सीजन का अधिग्रहण या हाइड्रोजन का ह्रास होता है, जिससे नए कार्यात्मक समूहों का निर्माण होता है।
- कार्बन यौगिकों में ऑक्सीकरण से तात्पर्य एक रासायनिक प्रतिक्रिया से है जिसमें कार्बन यौगिक से ऑक्सीजन का अधिग्रहण या हाइड्रोजन का ह्रास होता है, जिससे नए कार्यात्मक समूहों का निर्माण होता है।
- एथेनॉल को ऑक्सीकरण एजेंट क्षारीय KMnO4 (पोटेशियम परमैंगनेट) या अम्लीय पोटेशियम डाइक्रोमैट की उपस्थिति में कार्बोक्सिलिक एसिड में परिवर्तित किया जा सकता है।

3.3 जोड़ने की प्रतिक्रिया
- असंतृप्त हाइड्रोकार्बन उत्प्रेरक पैलडियम या निकेल की उपस्थिति में हाइड्रोजन जोड़ता है।
- वेजिटेबल ऑयल इस प्रक्रिया का उपयोग करके वेजिटेबल घी में परिवर्तित किया जाता है।
- इसे वेजिटेबल ऑयल का हाइड्रजनेशन भी कहा जाता है।

3.4 प्रतिस्थापन प्रतिक्रिया
- क्लोरीन और एल्केन के बीच प्रतिक्रिया इस हलोकेनशन प्रक्रिया का एक उदाहरण है।
- जब इसे धूप में रखा जाता है, तो क्लोरीन अणु अत्यधिक प्रतिक्रियाशील क्लोरीन रेडिकल में विघटित होते हैं, जो एल्केन से हाइड्रोजन परमाणु को निकाल सकते हैं, जिससे हाइड्रोक्लोरिक एसिड (HCl) और एक हाइड्रोकार्बन रेडिकल बनता है।
- यह हाइड्रोकार्बन रेडिकल फिर एक और क्लोरीन अणु के साथ प्रतिक्रिया कर सकता है, हाइड्रोजन परमाणु को क्लोरीन परमाणु के साथ प्रतिस्थापित करते हुए और एक क्लोरोएल्केन बनाता है।
- CH4 + Cl2 → CH3Cl + HCl (धूप की उपस्थिति में)
4. कुछ महत्वपूर्ण कार्बन यौगिक: एथेनॉल या एथिल अल्कोहल
4.1 एथेनॉल के गुण
4.1 एथेनॉल के गुण
भौतिक गुण
- रंगहीन, सुगंधित और जलने का स्वाद।
- पानी में घुलनशील।
- कम उबलने वाले बिंदु (351 K) वाला वाष्पशील तरल।
- तटस्थ यौगिक।
(i) सोडियम के साथ अभिक्रिया
यह अभिक्रिया एथेनॉल के परीक्षण के लिए H2 गैस का उत्सर्जन करते हुए उपयोग की जाती है (पॉप ध्वनि के साथ जलना)।
2Na + 2CH3CH2OH → 2CH3CH2O–Na + H2
(ii) निर्जलीकरण
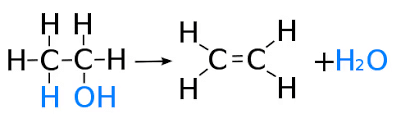
4.2 एथेनोइक एसिड के गुण
- रंगहीन तरल, खट्टा स्वाद और सिरके की गंध।
- उबलने का बिंदु 391 K है।
- जब शुद्ध CH3COOH को जमाया जाता है, तो यह रंगहीन बर्फ जैसा ठोस बनाता है। इसलिए इसे ग्लेशियल एसिटिक एसिड कहा जाता है।
(i) एस्टरकरण

मीठी सुगंधित एस्टर बनती है।
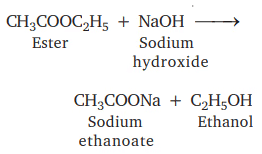
यह सैपोनिफिकेशन है क्योंकि साबुन इसी से तैयार किया जाता है।
(ii) आधार के साथ अभिक्रिया
NaOH + CH3COOH → CH3COONa + H2O
(iii) कार्बोनेट्स और हाइड्रोजन कार्बोनेट्स के साथ अभिक्रिया:
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
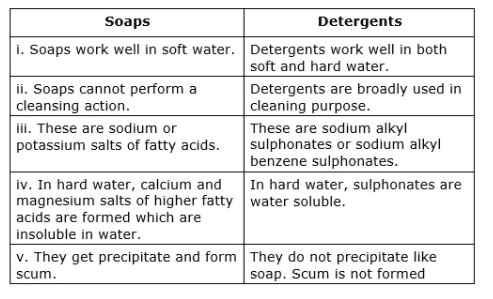
5. साबुन और डिटर्जेंट
- साबुन लंबे श्रृंखला वाले कार्बोक्जिलिक एसिड का सोडियम या पोटेशियम नमक होता है। उदाहरण: C17H35COONa
- साबुन केवल नरम पानी में प्रभावी होते हैं।
- डिटर्जेंट लंबे श्रृंखला वाले कार्बोक्जिलिक एसिड का अमोनियम या सल्फोनेट नमक होते हैं।
- डिटर्जेंट दोनों, कठिन और नरम पानी में प्रभावी होते हैं।
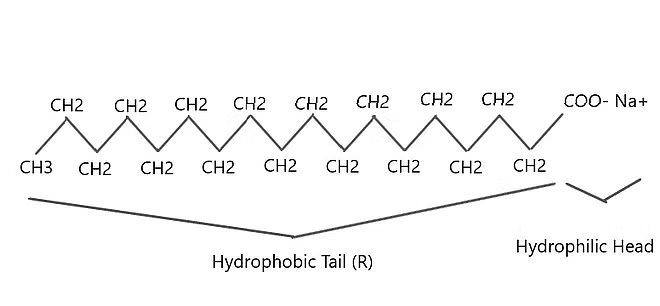
एक साबुन अणु में:
(i) आयनिक (हाइड्रोफिलिक) हिस्सा
(ii) लंबी हाइड्रोकार्बन श्रृंखला (हाइड्रोफोबिक) हिस्सा
साबुन का सफाई क्रिया
अधिकतर गंदगी तैलीय होती है और हाइड्रोफोबिक अंत गंदगी से जुड़ जाता है, जबकि आयनिक अंत पानी के अणुओं से घिर जाता है। इससे एक कर्णीय संरचना बनती है जिसे माइसेल्स कहा जाता है। साबुन माइसेल्स गंदगी और चिकनाई को पानी में घुलने में मदद करते हैं और कपड़े साफ होते हैं।
माइसेल गठन
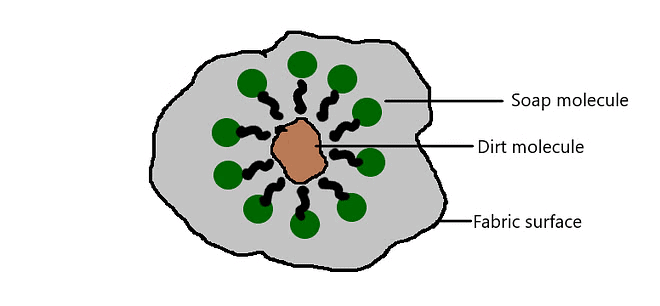
- कठोर पानी में मौजूद मैग्नीशियम और कैल्शियम के लवण साबुन के अणुओं के साथ प्रतिक्रिया करके एक अघुलनशील उत्पाद बनाते हैं जिसे स्कम कहा जाता है। यह स्कम सफाई क्रिया में कठिनाई उत्पन्न करता है।
- डिटर्जेंट के उपयोग से, कठोर पानी में अघुलनशील स्कम नहीं बनता और कपड़े प्रभावी ढंग से साफ होते हैं।
संश्लेषित डिटर्जेंट:
- डिटर्जेंट प्रभावी गैर-साबुन सफाई एजेंट हैं जो सतह-सक्रिय सामग्री का उपयोग करते हैं।
- संश्लेषित डिटर्जेंट, जिन्हें "साबुन रहित साबुन" कहा जाता है, कठोर या लवण युक्त पानी में प्रभावी होते हैं और स्कम नहीं बनाते।
- आधुनिक संश्लेषित डिटर्जेंट, जैसे कि आल्किल या आरिल सल्फोनेट्स, पेट्रोलियम और सल्फ्यूरिक एसिड से बनाए जाते हैं।
डिटर्जेंट के उदाहरण:
- प्रसिद्ध सल्फोनेट या सल्फेट डिटर्जेंट के दो मौलिक उदाहरण प्रस्तुत किए गए हैं।

डिटर्जेंट की सफाई क्रिया:
- संश्लेषित डिटर्जेंट की आणविक संरचना साबुन के समान सफाई क्रिया की अनुमति देती है, जिसमें माइसेल गठन और इमल्सीफिकेशन शामिल होता है।
- डिटर्जेंट कठोर पानी में अच्छे से झाग बनाते हैं, कैल्शियम या मैग्नीशियम आयनों को घुलाते हैं।
|
1 videos|326 docs|212 tests
|















