न्यूक्लियर रसायन विज्ञान: मूल बातें | विज्ञान और प्रौद्योगिकी (Science & Technology) for UPSC CSE PDF Download
परमाणु संख्या (Z)
किसी परमाणु की परमाणु संख्या वह संख्या है जो उसके प्रोटॉन या इलेक्ट्रॉन की संख्या को दर्शाती है। एक तटस्थ परमाणु में, प्रोटॉन की संख्या इलेक्ट्रॉन की संख्या के बराबर होती है, जो तत्व की पहचान को परिभाषित करती है।
उदाहरण: नाइट्रोजन (N) की परमाणु संख्या 7 है, कैल्शियम (Ca) की परमाणु संख्या 20 है, और ऑक्सीजन (O) की परमाणु संख्या 8 है।
द्रव्यमान संख्या (A)
किसी परमाणु की द्रव्यमान संख्या उसके नाभिक में मौजूद प्रोटॉन और न्यूट्रॉन का योग होती है। यह परमाणु के द्रव्यमान को निर्धारित करने में मदद करती है और इसे "A" प्रतीक द्वारा दर्शाया जाता है।
उदाहरण: नाइट्रोजन (N) की द्रव्यमान संख्या 14 है, कैल्शियम (Ca) की द्रव्यमान संख्या 40 है, और ऑक्सीजन (O) की द्रव्यमान संख्या 16 है।
आइसोटोप
आइसोटोप समान तत्व के वे परमाणु होते हैं जिनकी परमाणु संख्या (प्रोटॉन की संख्या) समान होती है लेकिन द्रव्यमान संख्या (न्यूट्रॉन की संख्या) भिन्न होती है। इस प्रकार, आइसोटोप की द्रव्यमान भिन्न होती है।
उदाहरण: प्रोटियम, ड्यूटेरियम, और ट्रिटियम हाइड्रोजन के आइसोटोप हैं। इनमें सभी में एक प्रोटॉन (Z = 1) होता है लेकिन न्यूट्रॉन की संख्या भिन्न होती है, जिससे उनकी द्रव्यमान संख्या अलग होती है।
आइसोबार
आइसोबार वे परमाणु या तत्व होते हैं जिनकी द्रव्यमान संख्या (कुल प्रोटॉन और न्यूट्रॉन की संख्या) समान होती है लेकिन परमाणु संख्या (प्रोटॉन की संख्या) भिन्न होती है। इसका मतलब है कि वे विभिन्न तत्वों से संबंधित होते हैं लेकिन उनकी द्रव्यमान समान होती है।
उदाहरण: 40S (सल्फर-40), 40Cl (क्लोरीन-40), 40Ar (आर्गन-40), 40K (पोटेशियम-40), और 40Ca (कैल्शियम-40) आइसोबार हैं। इन सभी की द्रव्यमान संख्या 40 है लेकिन परमाणु संख्या भिन्न है।
आलोट्रोप
आलोट्रोप एक ही तत्व के विभिन्न रूप या संरचनात्मक व्यवस्था होते हैं, जो विशिष्ट भौतिक और रासायनिक गुण प्रस्तुत करते हैं।
उदाहरण: हीरा और ग्रेफाइट कार्बन के आलोट्रोप हैं। दोनों कार्बन परमाणुओं से बने होते हैं, लेकिन उनकी क्रिस्टल संरचनाएं भिन्न होती हैं, जिससे उनके गुणों में अंतर आता है।
रेडियोधर्मिता
अस्थिर परमाणु नाभिक स्वचालित रूप से अधिक स्थिरता वाले नाभिकों में टूट जाते हैं, और इस प्रक्रिया को रेडियोधर्मिता कहा जाता है। इस टूटने की प्रक्रिया के दौरान जो ऊर्जा और कण निकलते हैं, उन्हें विकिरण कहा जाता है।
प्राकृतिक रेडियोधर्मिता के तीन प्रकार
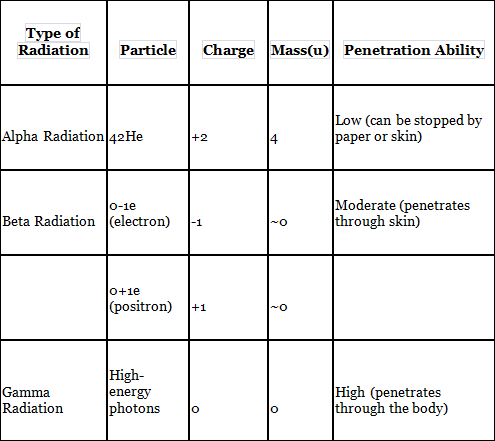
- अल्फा विकिरण: अल्फा विकिरण में एक रेडियोधर्मी नाभिक से अल्फा कणों का उत्सर्जन होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो हीलियम नाभिक के समकक्ष होता है।
उदाहरण: 23892U → 42He - बीटा विकिरण: बीटा विकिरण तब होता है जब एक रेडियोधर्मी नाभिक बीटा कणों का उत्सर्जन करता है। एक बीटा कण एक इलेक्ट्रॉन (0-1e) या एक पॉजिट्रॉन (0 1e) होता है।
उदाहरण: 23490Pa → 0-1e 23491U - गामा विकिरण: गामा विकिरण उच्च-ऊर्जा फोटॉनों से बना होता है जिनकी तरंग दैर्ध्य बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन नाभिक की परमाणु संख्या या द्रव्यमान संख्या को नहीं बदलता।
न्यूक्लियर प्रतिक्रियाएं
न्यूक्लियर प्रतिक्रियाओं में परमाणु नाभिक में परिवर्तन होते हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- न्यूक्लियर विखंडन: न्यूक्लियर विखंडन तब होता है जब एक परमाणु नाभिक दो या अधिक छोटे नाभिकों में बंट जाता है। उत्पन्न छोटे नाभिकों को विकिरण उत्पाद कहा जाता है, और न्यूट्रॉन, फोटॉनों या अल्फा कणों जैसे कण भी निकल सकते हैं।
उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n - न्यूक्लियर संलयन: न्यूक्लियर संलयन एक प्रक्रिया है जिसमें परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा मुक्त करती है।
उदाहरण: 11H + 21H → 32He
32He + 32He → 42He + 211H
11H + 11H → 21H + 0 + 1β
अल्फा, बीटा, और गामा विकिरण की तुलना:
परमाणु संख्या (Z)
किसी परमाणु की परमाणु संख्या उस में मौजूद प्रोटॉन या इलेक्ट्रॉनों की संख्या होती है। एक तटस्थ परमाणु में, प्रोटॉनों की संख्या इलेक्ट्रॉनों की संख्या के बराबर होती है, जो तत्व की पहचान को परिभाषित करती है।
- उदाहरण: नाइट्रोजन (N) की परमाणु संख्या 7 है, कैल्शियम (Ca) की परमाणु संख्या 20 है, और ऑक्सीजन (O) की परमाणु संख्या 8 है।
भार संख्या (A)
किसी परमाणु की भार संख्या उसके नाभिक में मौजूद प्रोटॉनों और न्यूट्रॉनों का योग होती है। यह परमाणु के भार को निर्धारित करने में मदद करती है और इसका प्रतीक "A" है।
- उदाहरण: नाइट्रोजन (N) की भार संख्या 14 है, कैल्शियम (Ca) की भार संख्या 40 है, और ऑक्सीजन (O) की भार संख्या 16 है।
आइसोटोप
आइसोटोप एक ही तत्व के ऐसे परमाणु होते हैं जिनकी परमाणु संख्या (प्रोटॉनों की संख्या) समान होती है, लेकिन उनकी भार संख्या (न्यूट्रॉनों की संख्या में भिन्नता) अलग होती है। इसलिए, आइसोटोप की परमाणु द्रव्यमान भिन्न होती है।
- उदाहरण: प्रोटियम, ड्यूटेरियम, और ट्रिटियम हाइड्रोजन के आइसोटोप हैं। इनके सभी में एक प्रोटॉन (Z = 1) होता है लेकिन न्यूट्रॉनों की संख्या भिन्न होती है, जो उन्हें अलग-अलग भार संख्याएँ देती है।
आइसोबार
आइसोबार वे परमाणु या तत्व होते हैं जिनकी भार संख्या (कुल प्रोटॉन और न्यूट्रॉन की संख्या) समान होती है लेकिन उनकी परमाणु संख्या (प्रोटॉनों की संख्या) भिन्न होती है। इसका अर्थ है कि वे विभिन्न तत्वों के होते हैं लेकिन उनका द्रव्यमान समान होता है।
- उदाहरण: 40S (सल्फर-40), 40Cl (क्लोरीन-40), 40Ar (आर्गन-40), 40K (पोटैशियम-40), और 40Ca (कैल्शियम-40) आइसोबार हैं। इन सभी की भार संख्या 40 है लेकिन परमाणु संख्या भिन्न है।
आलोट्रोप
आलोट्रोप एक ही तत्व के विभिन्न रूप या संरचनात्मक व्यवस्थाएँ होती हैं, जो भिन्न भौतिक और रासायनिक गुण प्रदर्शित करती हैं।
- उदाहरण: हीरा और ग्रेफाइट कार्बन के आलोट्रोप हैं। दोनों कार्बन परमाणुओं से बने होते हैं, लेकिन उनके क्रिस्टल संरचनाएँ भिन्न होती हैं, जिससे उनके गुणों में अंतर आता है।
रेडियोधर्मिता
अस्थिर परमाणु नाभिक स्वाभाविक रूप से अधिक स्थिर नाभिक बनाने के लिए विघटित होते हैं, और इस प्रक्रिया को रेडियोधर्मिता कहा जाता है। विघटन प्रक्रिया के दौरान निकलने वाली ऊर्जा और कणों को विकिरण कहा जाता है।
प्राकृतिक रेडियोधर्मिता के तीन प्रकार
- अल्फा विकिरण: अल्फा विकिरण में एक रेडियोधर्मी नाभिक से अल्फा कणों का उत्सर्जन होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो हीलियम नाभिक के बराबर होता है। उदाहरण: 23892U → 42He
- बीटा विकिरण: बीटा विकिरण तब होता है जब एक रेडियोधर्मी नाभिक बीटा कणों का उत्सर्जन करता है। एक बीटा कण एक इलेक्ट्रॉन (0-1e) या एक पोजिट्रॉन (0 1e) होता है। उदाहरण: 23490Pa → 0-1e 23491U
- गामा विकिरण: गामा विकिरण उच्च-ऊर्जा फोटॉन से बना होता है जिनकी तरंग दैर्ध्य बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन नाभिक की परमाणु संख्या या भार संख्या को परिवर्तित नहीं करता है।
परमाणु प्रतिक्रियाएँ
परमाणु प्रतिक्रियाएँ परमाणु नाभिक में बदलाव शामिल होती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- न्यूक्लियर विभाजन: न्यूक्लियर विभाजन तब होता है जब एक परमाणु नाभिक दो या अधिक छोटे नाभिकों में विभाजित होता है। निर्मित छोटे नाभिकों को विभाजन उत्पाद कहा जाता है, और न्यूट्रॉन, फोटॉन, या अल्फा कण जैसे कण भी निकल सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
- न्यूक्लियर संलयन: न्यूक्लियर संलयन एक प्रक्रिया है जिसमें परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा मुक्त करती है। उदाहरण: 11H + 21H → 32He, 32He + 32He → 42He + 211H, 11H + 11H → 21H + 0 1β
अल्फा, बीटा और गामा विकिरण की तुलना:
द्रव्यमान संख्या (A)
एक परमाणु का द्रव्यमान संख्या उसके नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन की राशि होती है। यह परमाणु के द्रव्यमान को निर्धारित करने में मदद करता है और इसे "A" प्रतीक से दर्शाया जाता है। उदाहरण: नाइट्रोजन (N) का द्रव्यमान संख्या 14 है, कैल्शियम (Ca) का द्रव्यमान संख्या 40 है, और ऑक्सीजन (O) का द्रव्यमान संख्या 16 है।
आइसोटोप
आइसोटोप समान तत्व के वे परमाणु होते हैं जिनका परमाणु संख्या (प्रोटॉन की संख्या) समान होती है लेकिन द्रव्यमान संख्या (न्यूट्रॉन की संख्या भिन्न होती है)। इसलिए, आइसोटोप के द्रव्यमान भिन्न होते हैं। उदाहरण: प्रोटियम, ड्यूटेरियम, और ट्रिटियम हाइड्रोजन के आइसोटोप हैं। इनके सभी में एक प्रोटॉन (Z = 1) होता है लेकिन न्यूट्रॉनों की संख्या भिन्न होती है, जिससे उनके द्रव्यमान संख्या अलग होती है।
आइसोबार
आइसोबार वे परमाणु या तत्व होते हैं जिनका द्रव्यमान संख्या (प्रोटॉन और न्यूट्रॉन की कुल संख्या) समान होती है लेकिन परमाणु संख्या (प्रोटॉन की संख्या) भिन्न होती है। इसका मतलब है कि ये विभिन्न तत्वों से संबंधित होते हैं लेकिन उनका द्रव्यमान समान होता है। उदाहरण: 40S (सल्फर-40), 40Cl (क्लोरीन-40), 40Ar (आर्गन-40), 40K (पोटेशियम-40), और 40Ca (कैल्शियम-40) आइसोबार हैं। इनके सभी का द्रव्यमान संख्या 40 है लेकिन परमाणु संख्या भिन्न है।
आलोट्रोप
आलोट्रोप एक ही तत्व के विभिन्न रूप या संरचनात्मक व्यवस्थाएँ हैं, जो अलग-अलग भौतिक और रासायनिक गुण प्रस्तुत करती हैं। उदाहरण: हीरा और ग्रेफाइट कार्बन के आलोट्रोप हैं। दोनों कार्बन परमाणुओं से बने होते हैं, लेकिन उनके क्रिस्टल संरचना भिन्न होती है, जिससे उनके गुणों में अंतर आता है।
रेडियोधर्मिता
अस्थिर परमाणु नाभिक स्वाभाविक रूप से उच्च स्थिरता वाले नाभिकों में विघटित होते हैं, और इस प्रक्रिया को रेडियोधर्मिता कहा जाता है। विघटन प्रक्रिया के दौरान RELEASE की गई ऊर्जा और कणों को विकिरण कहा जाता है।
प्राकृतिक रेडियोधर्मिता के तीन प्रकार
- अल्फा विकिरण: अल्फा विकिरण में एक रेडियोधर्मी नाभिक से अल्फा कणों का उत्सर्जन होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो हीलियम नाभिक के समान होते हैं। उदाहरण: 23892U → 42He
- बीटा विकिरण: बीटा विकिरण तब होता है जब एक रेडियोधर्मी नाभिक बीटा कणों का उत्सर्जन करता है। एक बीटा कण एक इलेक्ट्रॉन (0-1e) या एक पोजिट्रॉन (01e) होता है। उदाहरण: 23490Pa → 0-1e 23491U
- गामा विकिरण: गामा विकिरण उच्च ऊर्जा वाले फोटोन से बना होता है जिनकी तरंगदैर्ध्य बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन नाभिक के परमाणु संख्या या द्रव्यमान संख्या को नहीं बदलता।
न्यूक्लियर प्रतिक्रियाएँ
न्यूक्लियर प्रतिक्रियाएँ परमाणु नाभिक में परिवर्तन को शामिल करती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- न्यूक्लियर फिशन: न्यूक्लियर फिशन तब होती है जब एक परमाणु नाभिक दो या दो से अधिक छोटे नाभिकों में विभाजित होता है। उत्पादित छोटे नाभिकों को फिशन उत्पाद कहा जाता है, और न्यूट्रॉनों, फोटनों, या अल्फा कणों जैसे कण भी उत्सर्जित हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 1454Xe + 310n
- न्यूक्लियर फ्यूजन: न्यूक्लियर फ्यूजन एक प्रक्रिया है जिसमें परमाणु नाभिक एक साथ मिलकर भारी नाभिकों का निर्माण करते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा मुक्त करती है। उदाहरण: 11H + 21H → 32He; 32He + 32He → 42He + 21H; 11H + 11H → 21H + 01β
अल्फा, बीटा, और गामा विकिरण की तुलना:
आइसोटोप
आइसोटोप एक ही तत्व के ऐसे परमाणु होते हैं जिनका आणविक संख्या (प्रोटॉन की संख्या) समान होता है, लेकिन द्रव्यमान संख्या (न्यूट्रॉन की संख्या) भिन्न होती है। इस प्रकार, आइसोटोप की आणविक द्रव्यमान अलग-अलग होती है। उदाहरण: प्रोटियम, ड्यूटेरियम, और ट्रिटियम हाइड्रोजन के आइसोटोप हैं। इनके सभी में एक प्रोटॉन (Z = 1) होता है, लेकिन न्यूट्रॉन की संख्या अलग होती है, जिससे इनके द्रव्यमान संख्या भिन्न होती हैं।
आइसोबार
आइसोबार ऐसे परमाणु या तत्व होते हैं जिनकी द्रव्यमान संख्या (प्रोटॉन और न्यूट्रॉन की कुल संख्या) समान होती है, लेकिन आणविक संख्या (प्रोटॉन की संख्या) भिन्न होती है। इसका मतलब है कि ये विभिन्न तत्वों से संबंधित होते हैं लेकिन इनका द्रव्यमान समान होता है। उदाहरण: 40S (सल्फर-40), 40Cl (क्लोरीन-40), 40Ar (आर्गन-40), 40K (पोटेशियम-40), और 40Ca (कैल्शियम-40) आइसोबार हैं। इनकी द्रव्यमान संख्या 40 होती है लेकिन आणविक संख्या भिन्न होती है।
आलोट्रोप
आलोट्रोप एक ही तत्व के विभिन्न रूप या संरचनात्मक व्यवस्थाएँ होती हैं, जो अलग-अलग भौतिक और रासायनिक गुण प्रस्तुत करती हैं। उदाहरण: हीरा और ग्रेफाइट कार्बन के आलोट्रोप हैं। दोनों कार्बन परमाणुओं से बने होते हैं, लेकिन इनके क्रिस्टल संरचनाएं भिन्न होती हैं, जिससे इनके गुणों में अंतर आता है।
रेडियोधर्मिता
अस्थिर परमाणु नाभिक स्वाभाविक रूप से अधिक स्थिर नाभिक बनाने के लिए विघटन करते हैं, और इस प्रक्रिया को रेडियोधर्मिता कहा जाता है। विघटन प्रक्रिया के दौरान ऊर्जा और कणों का उत्सर्जन होने को रेडिएशन कहा जाता है।
प्राकृतिक रेडियोधर्मिता के तीन प्रकार
- अल्फा विकिरण: अल्फा विकिरण में एक रेडियोधर्मी नाभिक से अल्फा कणों का उत्सर्जन होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो हीलियम नाभिक के समान होते हैं। उदाहरण: 23892U → 42He
- बीटा विकिरण: बीटा विकिरण तब होता है जब एक रेडियोधर्मी नाभिक बीटा कणों का उत्सर्जन करता है। एक बीटा कण एक इलेक्ट्रॉन (0-1e) या एक पॉजिट्रॉन (0 1e) होता है। उदाहरण: 23490Pa → 0-1e 23491U
- गामा विकिरण: गामा विकिरण उच्च ऊर्जा वाले फोटोन का उत्सर्जन होता है जिनकी तरंग लंबाई बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन नाभिक की आणविक संख्या या आणविक द्रव्यमान को नहीं बदलता।
परमाणु प्रतिक्रियाएँ
परमाणु प्रतिक्रियाएँ परमाणु नाभिक में परिवर्तनों को शामिल करती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- परमाणु विखंडन: परमाणु विखंडन तब होता है जब एक परमाणु नाभिक दो या अधिक छोटे नाभिकों में विभाजित होता है। उत्पादित छोटे नाभिकों को विखंडन उत्पाद कहा जाता है, और न्यूट्रॉन, फोटोन, या अल्फा कण जैसे कण भी उत्सर्जित हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
- परमाणु संलयन: परमाणु संलयन एक प्रक्रिया है जिसमें परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। इस प्रक्रिया में बड़ी मात्रा में ऊर्जा मुक्त होती है। उदाहरण: 11H + 21H → 32He; 32He + 32He → 42He + 211H; 11H + 11H → 21H + 0 1β
अल्फा, बीटा, और गामा विकिरण की तुलना:
आइसोबार
आइसोबार वे परमाणु या तत्व होते हैं जिनका द्रव्यमान संख्या (प्रोटॉन और न्यूट्रॉन की कुल संख्या) समान होती है, लेकिन उनके परमाणु संख्या (प्रोटॉनों की संख्या) अलग-अलग होती है। इसका अर्थ है कि ये विभिन्न तत्वों के होते हैं लेकिन इनका द्रव्यमान समान होता है। उदाहरण: 40S (सल्फर-40), 40Cl (क्लोरीन-40), 40Ar (आर्गन-40), 40K (पोटेशियम-40) और 40Ca (कैल्शियम-40) आइसोबार हैं। इन सभी की द्रव्यमान संख्या 40 है लेकिन परमाणु संख्या अलग है।
आलोट्रोप्स
आलोट्रोप्स एक ही तत्व के विभिन्न रूप या संरचनात्मक व्यवस्थाएँ होती हैं, जो विशिष्ट भौतिक और रासायनिक गुण प्रस्तुत करती हैं। उदाहरण: हीरा और ग्रेफाइट कार्बन के आलोट्रोप्स हैं। दोनों कार्बन परमाणुओं से बने होते हैं, लेकिन इनकी क्रिस्टल संरचनाएँ अलग होती हैं, जिससे इनके गुणों में अंतर आता है।
रेडियोधर्मिता
अस्थिर परमाणु नाभिक स्वतः विघटन करते हैं ताकि अधिक स्थिर नाभिक का निर्माण हो सके, और इस प्रक्रिया को रेडियोधर्मिता कहा जाता है। विघटन प्रक्रिया के दौरान जो ऊर्जा और कण मुक्त होते हैं, उन्हें रेडिएशन कहा जाता है।
प्राकृतिक रेडियोधर्मिता के तीन प्रकार
- अल्फा रेडिएशन: अल्फा रेडिएशन में एक रेडियोधर्मी नाभिक से अल्फा कणों का उत्सर्जन होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो एक हीलियम नाभिक के समान है। उदाहरण: 23892U → 42He
- बीटा रेडिएशन: बीटा रेडिएशन तब होती है जब एक रेडियोधर्मी नाभिक बीटा कणों का उत्सर्जन करता है। एक बीटा कण एक इलेक्ट्रॉन (0-1e) या एक पॉजिट्रॉन (0 1e) होता है। उदाहरण: 23490Pa → 0-1e 23491U
- गामा रेडिएशन: गामा रेडिएशन उच्च-ऊर्जा फ़ोटॉन होते हैं जिनकी तरंगदैर्ध्य बहुत छोटी होती है। अल्फा और बीटा रेडिएशन के विपरीत, गामा उत्सर्जन नाभिक की परमाणु संख्या या द्रव्यमान को नहीं बदलता।
नाभिकीय प्रतिक्रियाएँ
नाभिकीय प्रतिक्रियाएँ परमाणु नाभिक में परिवर्तन को शामिल करती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- नाभिकीय विखंडन: नाभिकीय विखंडन तब होता है जब एक परमाणु नाभिक दो या दो से अधिक छोटे नाभिकों में विभाजित होता है। उत्पन्न छोटे नाभिकों को विखंडन उत्पाद कहा जाता है, और न्यूट्रॉन, फ़ोटॉन या अल्फा कण जैसे कण भी मुक्त हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
- नाभिकीय संलयन: नाभिकीय संलयन एक प्रक्रिया है जिसमें परमाणु नाभिक एक साथ मिलकर भारी नाभिकों का निर्माण करते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा मुक्त करती है। उदाहरण: 11H + 21H → 32He; 32He + 32He → 42He + 211H; 11H + 11H + 11H → 21H + 0 + 1β
अल्फा, बीटा और गामा रेडिएशन की तुलना
अलोट्रोप
अलोट्रोप एक ही तत्व के विभिन्न रूप या संरचनात्मक व्यवस्थाएँ हैं, जो अलग-अलग भौतिक और रासायनिक गुण प्रस्तुत करती हैं। उदाहरण: हीरा और ग्रेफाइट कार्बन के अलोट्रोप हैं। दोनों कार्बन परमाणुओं से बने होते हैं, लेकिन उनके क्रिस्टल संरचनाएँ अलग होती हैं, जिसके परिणामस्वरूप भिन्न गुण उत्पन्न होते हैं।
रेडियोधर्मिता
अस्थिर परमाणु नाभिक स्वाभाविक रूप से उच्च स्थिरता वाले नाभिकों में विघटित होते हैं, और इस प्रक्रिया को रेडियोधर्मिता कहा जाता है। विघटन प्रक्रिया के दौरान मुक्त होने वाली ऊर्जा और कणों को विकिरण कहा जाता है।
प्राकृतिक रेडियोधर्मिता के तीन प्रकार
- अल्फा विकिरण: अल्फा विकिरण में एक रेडियोधर्मी नाभिक से अल्फा कणों का उत्सर्जन होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो हीलियम नाभिक के बराबर होता है। उदाहरण: 23892U → 42He 23490Th
- बीटा विकिरण: बीटा विकिरण तब होता है जब एक रेडियोधर्मी नाभिक बीटा कणों का उत्सर्जन करता है। एक बीटा कण या तो एक इलेक्ट्रॉन (0-1e) या एक पॉजिट्रॉन (01e) होता है। उदाहरण: 23490Pa → 0-1e 23491U
- गामा विकिरण: गामा विकिरण उच्च-ऊर्जा फोटॉनों से बना होता है जिनकी तरंग दैर्ध्य बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन नाभिक के परमाणु संख्या या परमाणु द्रव्यमान को बदलता नहीं है।
न्यूक्लियर प्रतिक्रियाएँ
न्यूक्लियर प्रतिक्रियाएँ परमाणु नाभिक में परिवर्तन शामिल होती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- न्यूक्लियर विघटन: न्यूक्लियर विघटन तब होता है जब एक परमाणु नाभिक दो या अधिक छोटे नाभिकों में विभाजित होता है। उत्पन्न छोटे नाभिकों को विघटन उत्पाद कहा जाता है, और न्यूट्रॉन, फोटॉन, या अल्फा कण जैसे कण भी मुक्त हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
- न्यूक्लियर संलयन: न्यूक्लियर संलयन एक प्रक्रिया है जिसमें परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा मुक्त करती है। उदाहरण: 11H + 21H → 32He, 32He + 32He → 42He + 2 × 11H
अल्फा, बीटा, और गामा विकिरण की तुलना:
रेडियोधर्मिता
अस्थिर परमाणु नाभिक स्वचालित रूप से उच्च स्थिरता वाले नाभिकों में विघटित होते हैं, और इस प्रक्रिया को रेडियोधर्मिता कहा जाता है। विघटन प्रक्रिया के दौरान जारी ऊर्जा और कणों को आवेश कहा जाता है।
प्राकृतिक रेडियोधर्मिता के तीन प्रकार
- अल्फा विकिरण: अल्फा विकिरण में एक रेडियोधर्मी नाभिक से अल्फा कणों का उत्सर्जन होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो हीलियम नाभिक के समकक्ष है। उदाहरण: 23892U → 42He
- बीटा विकिरण: बीटा विकिरण तब होता है जब एक रेडियोधर्मी नाभिक बीटा कणों का उत्सर्जन करता है। एक बीटा कण एक इलेक्ट्रॉन (0-1e) या एक पोजिट्रॉन (01e) हो सकता है। उदाहरण: 23490Pa → 0-1e 23491U
- गामा विकिरण: गामा विकिरण उच्च ऊर्जा वाले फोटॉनों से बना होता है जिनकी तरंग दैर्ध्य बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन नाभिक के परमाणु संख्या या परमाणु द्रव्यमान को परिवर्तित नहीं करता है।
न्यूक्लियर प्रतिक्रियाएँ
न्यूक्लियर प्रतिक्रियाएँ परमाणु नाभिकों में परिवर्तन शामिल होती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- न्यूक्लियर विखंडन: न्यूक्लियर विखंडन तब होता है जब एक परमाणु नाभिक दो या अधिक छोटे नाभिकों में विभाजित होता है। उत्पन्न छोटे नाभिकों को विखंडन उत्पाद कहा जाता है, और नुट्रॉन, फोटॉन या अल्फा कण जैसे कण भी जारी हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354X + 310n
- न्यूक्लियर संलयन: न्यूक्लियर संलयन एक प्रक्रिया है जहाँ परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा जारी करती है। उदाहरण: 11H + 21H → 32He; 32He + 32He → 42He + 211H; 11H + 11H + 11H → 21H + 01β
अल्फा, बीटा, और गामा विकिरण की तुलना
अल्फा विकिरण:
अल्फा विकिरण में एक रेडियोधर्मी न्यूक्लियस से अल्फा कणों का उत्सर्जन शामिल होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो एक हीलियम न्यूक्लियस के समान होते हैं। उदाहरण: 23892U → 42He 23490Th
बीटा विकिरण:
बीटा विकिरण तब होता है जब एक रेडियोधर्मी न्यूक्लियस बीटा कणों का उत्सर्जन करता है। एक बीटा कण एक इलेक्ट्रॉन (0-1e) या एक पॉज़िट्रॉन (01e) हो सकता है। उदाहरण: 23490Pa → 0-1e 23491U
गामा विकिरण:
गामा विकिरण उच्च-ऊर्जा फोटॉनों से बना होता है जिनकी तरंग दैर्ध्य बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन न्यूक्लियस के परमाणु संख्या या परमाणु द्रव्यमान को नहीं बदलता।
न्यूक्लियर प्रतिक्रिया:
न्यूक्लियर प्रतिक्रियाएँ परमाणु न्यूक्लियस में परिवर्तन शामिल करती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- न्यूक्लियर विखंडन: यह तब होता है जब एक परमाणु न्यूक्लियस दो या अधिक छोटे न्यूक्लियस में विभाजित होता है। उत्पन्न छोटे न्यूक्लियस को विखंडन उत्पाद कहा जाता है, और न्युट्रॉन, फोटॉन या अल्फा कण जैसे कण भी जारी हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
- न्यूक्लियर संलयन: यह एक प्रक्रिया है जिसमें परमाणु न्यूक्लियस एक साथ जुड़कर भारी न्यूक्लियस बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा मुक्त करती है। उदाहरण: 11H + 21H → 32He; 32He + 32He → 42He + 21H; 11H + 11H + 11H → 21H + 01β
अल्फा, बीटा, और गामा विकिरण की तुलना:
अल्फा विकिरण में एक रेडियोधर्मी न्यूक्लियस से अल्फा कणों का उत्सर्जन शामिल होता है। एक अल्फा कण में 2 प्रोटॉन और 2 न्यूट्रॉन होते हैं, जो एक हीलियम न्यूक्लियस के समान होते हैं। उदाहरण: 23892U → 42He 23490Th
बीटा विकिरण
बीटा विकिरण तब होता है जब एक radioactive nucleus बीटा कणों को उत्सर्जित करता है। एक बीटा कण एक इलेक्ट्रॉन (0-1e) या एक पॉज़िट्रॉन (0 1e) होता है। उदाहरण: 23490Pa → 0-1e 23491U
गामा विकिरण
गामा विकिरण उच्च-ऊर्जा फोटॉनों से बना होता है जिनकी तरंग दैर्ध्य बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन नाभिक के atomic number या atomic mass को नहीं बदलता है।
नाभिकीय प्रतिक्रियाएँ
नाभिकीय प्रतिक्रियाएँ परमाणु नाभिकों में परिवर्तन शामिल होती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
नाभिकीय विखंडन
नाभिकीय विखंडन तब होता है जब एक परमाणु नाभिक दो या दो से अधिक छोटे नाभिकों में विभाजित होता है। उत्पन्न छोटे नाभिकों को fission products कहा जाता है, और न्यूट्रॉन, फोटॉन, या अल्फा कण जैसे कण भी मुक्त हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
नाभिकीय संलयन
नाभिकीय संलयन एक प्रक्रिया है जहाँ परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा मुक्त करती है। उदाहरण: 11H + 21H → 32He
32He + 32He → 42He + 2 11H
11H + 11H → 21H + 01β
अल्फा, बीटा और गामा विकिरण की तुलना:
गामा विकिरण
गामा विकिरण उच्च-ऊर्जा फोटॉनों से बना होता है जिनकी तरंग दैर्ध्य बहुत छोटी होती है। अल्फा और बीटा विकिरण के विपरीत, गामा उत्सर्जन नाभिक के परमाणु संख्या या परमाणु द्रव्यमान को नहीं बदलता।
परमाणु प्रतिक्रियाएँ
परमाणु प्रतिक्रियाएँ परमाणु नाभिक में परिवर्तन से संबंधित होती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- परमाणु विखंडन: परमाणु विखंडन तब होता है जब एक परमाणु नाभिक दो या दो से अधिक छोटे नाभिकों में विभाजित होता है। उत्पन्न छोटे नाभिकों को विखंडन उत्पाद कहा जाता है, और न्यूट्रॉन, फोटॉन, या अल्फा कण जैसे कण भी उत्सर्जित हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
- परमाणु संलयन: परमाणु संलयन एक प्रक्रिया है जहाँ परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा释放 करती है। उदाहरण: 11H + 21H → 32He, 32He + 32He → 42He + 211H, 11H + 11H → 21H + 0 + 1β
अल्फा, बीटा, और गामा विकिरण की तुलना:
परमाणु प्रतिक्रियाएँ परमाणु नाभिक में परिवर्तन से संबंधित होती हैं और इन्हें दो प्रकारों में वर्गीकृत किया जा सकता है:
- परमाणु विखंडन: परमाणु विखंडन तब होता है जब एक परमाणु नाभिक दो या दो से अधिक छोटे नाभिकों में विभाजित होता है। उत्पन्न छोटे नाभिकों को विखंडन उत्पाद कहा जाता है, और न्यूट्रॉन, फोटॉन, या अल्फा कण जैसे कण भी उत्सर्जित हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
- परमाणु संलयन: परमाणु संलयन एक प्रक्रिया है जहाँ परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा释放 करती है। उदाहरण: 11H + 21H → 32He, 32He + 32He → 42He + 211H, 11H + 11H → 21H + 0 + 1β
न्यूक्लियर फिशन
न्यूक्लियर फिशन तब होती है जब एक परमाणु नाभिक दो या अधिक छोटे नाभिकों में विभाजित होता है। उत्पन्न छोटे नाभिकों को फिशन उत्पाद कहा जाता है, और इस प्रक्रिया में न्यूट्रॉन, फोटॉन या अल्फा कण जैसे कण भी मुक्त हो सकते हैं। उदाहरण: 23592U + 10n → 9038Sr + 14354Xe + 310n
न्यूक्लियर फ्यूजन
न्यूक्लियर फ्यूजन एक प्रक्रिया है जिसमें परमाणु नाभिक एक साथ मिलकर भारी नाभिक बनाते हैं। यह प्रक्रिया बड़ी मात्रा में ऊर्जा छोड़ती है। उदाहरण: 11H + 21H → 32He, 32He → 42He, 11H + 11H → 21H + 0 + 1β
अल्फा, बीटा, और गामा विकिरण की तुलना:
- 11H + 21H → 32He
- 32He + 32He → 42He + 21H
- 11H + 11H → 21H + 0 + 1β
|
1 videos|326 docs|212 tests
|




















