NCERT सारांश: भौतिकी- 1 का सारांश | विज्ञान और प्रौद्योगिकी (Science & Technology) for UPSC CSE PDF Download
परमाणु भौतिकी
एक परमाणु उस तत्व का सबसे छोटा कण है जो स्वतंत्र रूप से अस्तित्व में रह सकता है और अपनी सभी रासायनिक गुणों को बनाए रख सकता है।
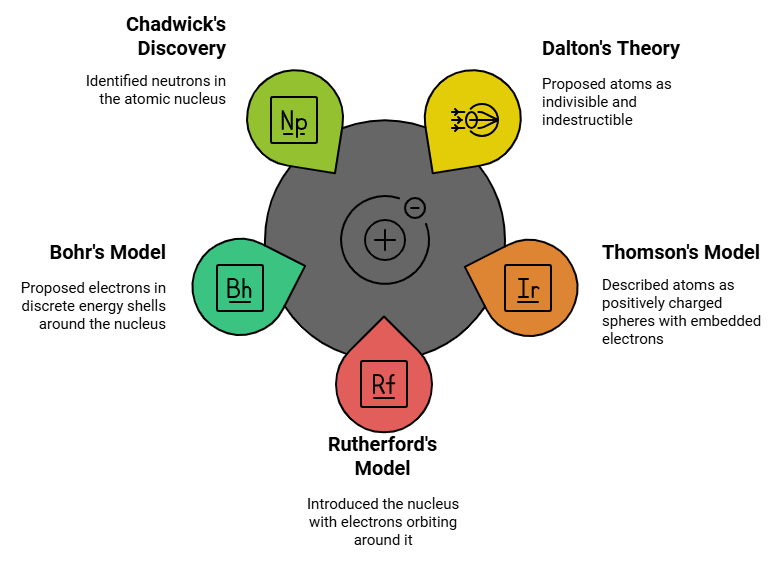
1. डाल्टन का परमाणु सिद्धांत: इसने सुझाव दिया कि परमाणु अविभाज्य और नाशनीय था। लेकिन परमाणु के अंदर दो मौलिक कणों (इलेक्ट्रॉन और प्रोटॉन) की खोज ने डाल्टन के इस सिद्धांत के इस पहलू की विफलता को दर्शाया।
2. थॉमसन का परमाणु सिद्धांत
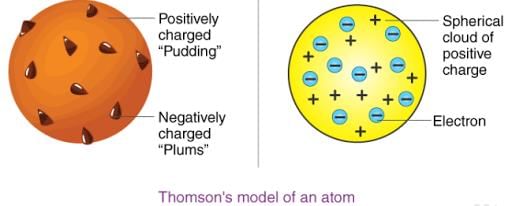
थॉमसन ने प्रस्तावित किया कि: (i) एक परमाणु एक सकारात्मक चार्ज वाले गोले से बना होता है और इलेक्ट्रॉन इसमें निहित होते हैं। (ii) नकारात्मक और सकारात्मक चार्ज का परिमाण समान होता है। इसलिए, संपूर्ण परमाणु विद्युत रूप से तटस्थ होता है।
3. रदरफोर्ड का परमाणु मॉडल: रदरफोर्ड का अल्फा-कण बिखराव प्रयोग
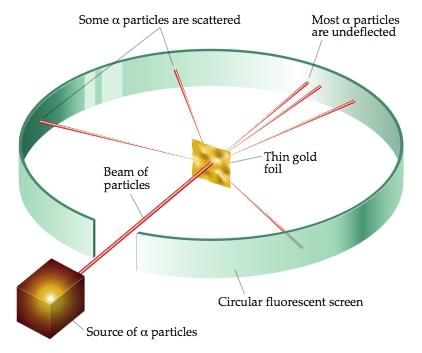
- रदरफोर्ड का अल्फा-कण बिखराव प्रयोग परमाणु नाभिक की खोज का कारण बना।
- रदरफोर्ड के परमाणु मॉडल ने प्रस्तावित किया कि परमाणु के अंदर एक बहुत छोटा नाभिक होता है और इलेक्ट्रॉन इस नाभिक के चारों ओर घूमते हैं।
इस मॉडल द्वारा परमाणु की स्थिरता को समझाया नहीं जा सका।
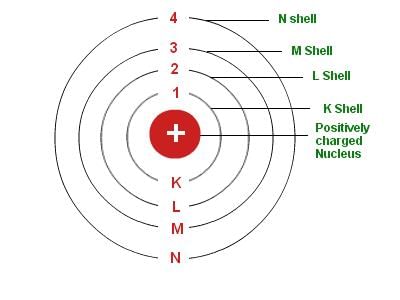
4. बॉहर का मॉडल: नील्स बॉहर का परमाणु मॉडल अधिक सफल था। उन्होंने प्रस्तावित किया कि इलेक्ट्रॉन नाभिक के चारों ओर अलग-अलग शेलों में विशिष्ट ऊर्जा के साथ वितरित होते हैं। यदि परमाणु के शेल पूरे हैं, तो परमाणु स्थिर होगा और कम प्रतिक्रियाशील होगा।
5. जेम्स चैडविक की खोज: J. Chadwick ने परमाणु के नाभिक में न्यूट्रॉनों की उपस्थिति की खोज की। एक परमाणु के तीन उप-परमाण्विक कण हैं:
- (i) इलेक्ट्रॉन
- (ii) प्रोटॉन
- (iii) न्यूट्रॉन
इलेक्ट्रॉन नकारात्मक चार्ज वाले होते हैं, प्रोटॉन सकारात्मक चार्ज वाले होते हैं और न्यूट्रॉन में कोई चार्ज नहीं होता है। एक इलेक्ट्रॉन का द्रव्यमान लगभग हाइड्रोजन परमाणु के द्रव्यमान का 1/2000 होता है। प्रोटॉन और न्यूट्रॉन का द्रव्यमान एक-एक इकाई के रूप में लिया जाता है।
- हम जानते हैं कि प्रोटॉन एक परमाणु के नाभिक में उपस्थित होते हैं। यह एक परमाणु के प्रोटॉन की संख्या होती है, जो इसके परमाणु संख्या को निर्धारित करती है। इसे 'Z' से दर्शाया जाता है। एक तत्व के सभी परमाणुओं की परमाणु संख्या समान होती है, Z। वास्तव में, तत्वों की परिभाषा उनके प्रोटॉनों की संख्या द्वारा होती है।
- एक परमाणु का द्रव्यमान व्यावहारिक रूप से केवल प्रोटॉनों और न्यूट्रॉनों के कारण होता है। ये एक परमाणु के नाभिक में उपस्थित होते हैं। इसलिए प्रोटॉन और न्यूट्रॉन को न्यूक्लियॉन भी कहा जाता है। अतः, एक परमाणु का द्रव्यमान इसके नाभिक में स्थित होता है।
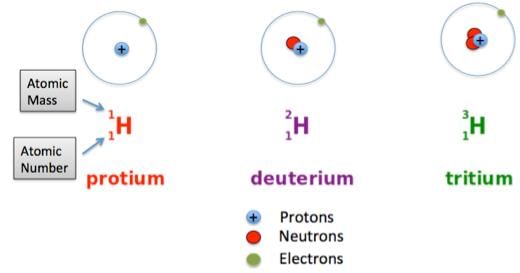
- आइसोटोप वे परमाणु होते हैं जो एक ही तत्व के होते हैं, लेकिन जिनके द्रव्यमान संख्या भिन्न होती है।
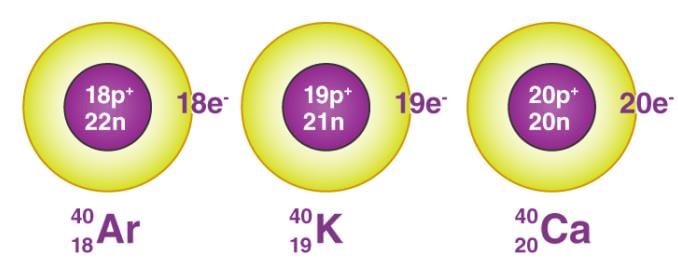
- आइसोबार वे परमाणु होते हैं जिनके द्रव्यमान संख्या समान होती है लेकिन परमाणु संख्या भिन्न होती है।
न्यूक्लियर बल
- एक नाभिक को एक साथ बांधने के लिए एक अलग प्रकार की मजबूत आकर्षक शक्ति होनी चाहिए। यह शक्ति इतनी मजबूत होनी चाहिए कि यह (सकारात्मक चार्ज वाले) प्रोटॉनों के बीच के प्रतिकर्षण को पार कर सके और प्रोटॉनों और न्यूट्रॉनों को छोटे नाभिकीय क्षेत्र में बांध सके। इस बल को न्यूक्लियर बल कहा जाता है।
- न्यूक्लियर बल कोलंब बल की तुलना में बहुत मजबूत होता है जो चार्ज के बीच होता है या द्रव्यमानों के बीच गुरुत्वाकर्षण बल होता है। न्यूट्रॉन-न्यूट्रॉन, प्रोटॉन-न्यूट्रॉन और प्रोटॉन-प्रोटॉन के बीच न्यूक्लियर बल लगभग समान होता है। न्यूक्लियर बल विद्युत चार्ज पर निर्भर नहीं होता है।
रेडियोधर्मिता
- रेडियोधर्मिता तब होती है जब एक परमाणु नाभिक छोटे कणों में टूटता है। परमाणु विकिरण के तीन प्रकार होते हैं: अल्फा, बीटा, और गामा। अल्फा कण सकारात्मक रूप से चार्ज होते हैं, बीटा कण नकारात्मक रूप से चार्ज होते हैं, और गामा कणों का कोई चार्ज नहीं होता। विकिरण में ऊर्जा के स्तर भी बढ़ते हैं, पहले अल्फा, फिर बीटा, और अंत में गामा, जो इन सभी में सबसे अधिक ऊर्जा वाला होता है। अल्फा और बीटा कण होते हैं, लेकिन गामा एक तरंग है। जब एक रेडियोधर्मी नाभिक बदलता है, तो शेष नाभिक (और परमाणु) पहले जैसा नहीं रहता। इसकी पहचान बदल जाती है। आधा जीवन उस समय को दर्शाता है जो एक नमूने में आधे परमाणुओं के बदलने में लगता है, और आधे वही रहते हैं। कार्बन का एक रेडियोधर्मी समस्थानिक, कार्बन-14, भी है। सामान्य कार्बन कार्बन-12 है। C-14 में दो अतिरिक्त न्यूट्रॉन होते हैं और इसका आधा जीवन 5730 वर्ष होता है। वैज्ञानिक C-14 का उपयोग एक प्रक्रिया में करते हैं जिसे कार्बन डेटिंग कहा जाता है। यह प्रक्रिया तब नहीं होती जब दो कार्बन परमाणु एक रात मॉल में जाते हैं। कार्बन डेटिंग तब होती है जब वैज्ञानिक बहुत पुराने पदार्थों की आयु मापने की कोशिश करते हैं। वातावरण में C-14 की बहुत कम मात्रा होती है। हर जीवित चीज में कुछ C-14 होता है। वैज्ञानिक उन चीजों में C-14 की संख्या मापते हैं जो वे खुदाई करते हैं ताकि यह अनुमान लगा सकें कि वे कितने पुराने हैं। वे इस वस्तु की तारीख लगाने के लिए 5730 वर्ष के आधा जीवन पर निर्भर करते हैं।
फिशन और फ्यूजन प्रतिक्रियाएँ
- फिशन एक परमाणु का विभाजन है। सभी परमाणु फिशन से नहीं गुजरते हैं, वास्तव में, सामान्य परिस्थितियों में बहुत कम ऐसा करते हैं। एक परमाणु प्रतिक्रिया में, वैज्ञानिक यूरेनियम-235 परमाणुओं पर कई न्यूट्रॉनों की बौछार करते हैं। जब एक न्यूट्रॉन नाभिक पर hits करता है, तो यूरेनियम U-236 बन जाता है। जब यह 236 बन जाता है, तो यूरेनियम परमाणु विभाजित होना चाहता है। विभाजित होने के बाद, यह तीन न्यूट्रॉनों और बहुत सारी ऊर्जा को छोड़ता है। वे न्यूट्रॉन क्षेत्र में तीन अन्य U परमाणुओं पर hits करते हैं और उन्हें U-236 बना देते हैं। प्रत्येक चक्र में प्रतिक्रिया तीन गुना बड़ी होती जाती है। एक प्रतिक्रिया जो एक बार शुरू होने पर अपने आप जारी रहती है, उसे श्रृंखला प्रतिक्रिया कहा जाता है।
- फ्यूजन की प्रक्रिया दो छोटे परमाणु नाभिकों का एक साथ आना है जिससे एक बड़ा स्थिर नाभिक बने। उपयोग के लिए सबसे सरल नाभिक ड्यूटेरियम और ट्रिटियम (हाइड्रोजन के समस्थानिक) हैं।
ताप
तापमान एक सापेक्ष माप या गर्मी या ठंड का संकेत है। गर्मी वह ऊर्जा है जो दो (या अधिक) प्रणालियों के बीच या एक प्रणाली और उसके परिवेश के बीच तापमान के अंतर के कारण स्थानांतरित होती है। स्थानांतरित गर्मी ऊर्जा की SI इकाई जूल (J) में व्यक्त की जाती है, जबकि तापमान की SI इकाई केल्विन (K) है, और °C तापमान की एक सामान्य उपयोग की जाने वाली इकाई है। थर्मामीटर एक उपकरण है जिसका उपयोग तापमान मापने के लिए किया जाता है। दो परिचित तापमान मापन पैमाने फारेनहाइट और सेल्सियस हैं। सेल्सियस तापमान (Tc) और फारेनहाइट तापमान (Tf) का संबंध इस प्रकार है: Tf = (9/5) Tc + 32।
प्रिंसिपल के अनुसार, तापमान का कोई ऊपरी सीमा नहीं है लेकिन एक निश्चित निचली सीमा है - पूर्ण शून्य। यह सीमित तापमान सेल्सियस तापमान पैमाने पर -273.16° है। क्लिनिकल थर्मामीटर हमारे शरीर का तापमान मापने के लिए उपयोग किया जाता है। इस थर्मामीटर की सीमा 35°C से 42°C तक होती है। अन्य उद्देश्यों के लिए, हम प्रयोगशाला थर्मामीटर का उपयोग करते हैं। इन थर्मामीटर की सीमा सामान्यतः -10°C से 110°C तक होती है। मानव शरीर का सामान्य तापमान 37°C है।
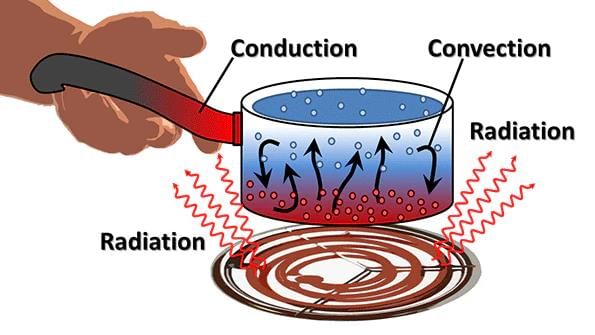
- गर्मी उच्च तापमान वाले शरीर से निम्न तापमान वाले शरीर की ओर प्रवाहित होती है। गर्मी के प्रवाह के तीन तरीके हैं: संवहन, संवहन और विकिरण।
- (a) संवहन: वह प्रक्रिया जिसके द्वारा गर्मी एक वस्तु के गर्म सिरे से ठंडे सिरे की ओर स्थानांतरित होती है, उसे संवहन कहा जाता है। ठोस पदार्थों में आमतौर पर गर्मी संवहन द्वारा स्थानांतरित होती है। जो सामग्री गर्मी को आसानी से पारित करने देती हैं, वे गर्मी के संवाहक कहलाते हैं। उदाहरण: एल्यूमिनियम, आयरन और कॉपर। जो सामग्री गर्मी को आसानी से पारित नहीं होने देती हैं, वे गर्मी के कमजोर संवाहक होती हैं जैसे कि प्लास्टिक और लकड़ी। कमजोर संवाहक को इंसुलेटर कहा जाता है।
- (b) संवहन: गर्मी को एक स्थान से दूसरे स्थान पर तरल और गैसों की वास्तविक गति द्वारा ले जाया जाता है। तरल और गैसों में, गर्मी संवहन द्वारा स्थानांतरित होती है। तटीय क्षेत्रों में रहने वाले लोगों को एक दिलचस्प घटना का अनुभव होता है। दिन के समय, भूमि पानी की तुलना में तेजी से गर्म होती है। भूमि के ऊपर की हवा गर्म होकर ऊपर उठ जाती है। समुद्र से ठंडी हवा भूमि की ओर आती है। यह गर्म हवा समुद्र की ओर जाती है। समुद्र की हवा को समुद्री ब्रीज कहा जाता है। रात में, यह ठीक उल्टा होता है। पानी भूमि की तुलना में अधिक धीरे-धीरे ठंडा होता है। इसलिए, भूमि से ठंडी हवा समुद्र की ओर जाती है। इसे भूमि ब्रीज कहा जाता है।
- (c) विकिरण: विकिरण द्वारा गर्मी का स्थानांतरण किसी भी माध्यम की आवश्यकता नहीं होती। यह तब भी हो सकता है जब कोई माध्यम उपस्थित न हो। गहरे रंग की वस्तुएं हल्के रंग की वस्तुओं की तुलना में विकिरण को बेहतर तरीके से अवशोषित करती हैं। यही कारण है कि गर्मियों में हम हल्के रंग की कपड़ों में अधिक आराम महसूस करते हैं। ऊनी कपड़े हमें सर्दियों में गर्म रखते हैं। इसका कारण यह है कि ऊन गर्मी का कमजोर संवाहक है और इसमें रेशों के बीच हवा फंसी होती है।
- एक शरीर के तापमान में परिवर्तन उसके आकार में परिवर्तन का कारण बनता है। तापमान में वृद्धि के कारण एक शरीर के आकार में वृद्धि को थर्मल एक्सपैंशन कहा जाता है। लंबाई में वृद्धि को रेखीय विस्तार कहा जाता है। क्षेत्र में वृद्धि को क्षेत्र विस्तार कहा जाता है। मात्रा में वृद्धि को वॉल्यूम विस्तार कहा जाता है।
- एक दिए गए पदार्थ के 1° तक तापमान बढ़ाने के लिए आवश्यक गर्मी ऊर्जा की मात्रा को गर्मी क्षमता या थर्मल क्षमता कहा जाता है। इसकी SI इकाई (J/K) है।
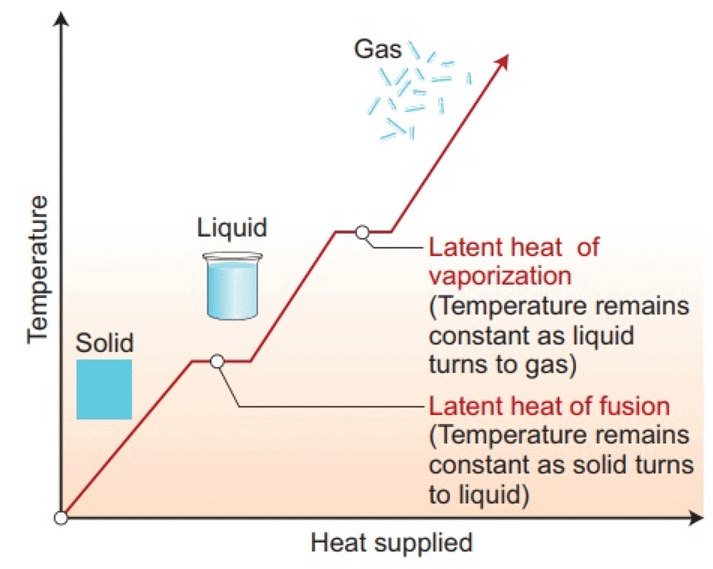
गर्म और वाष्पीकरण का निहित गर्मी चार्ट
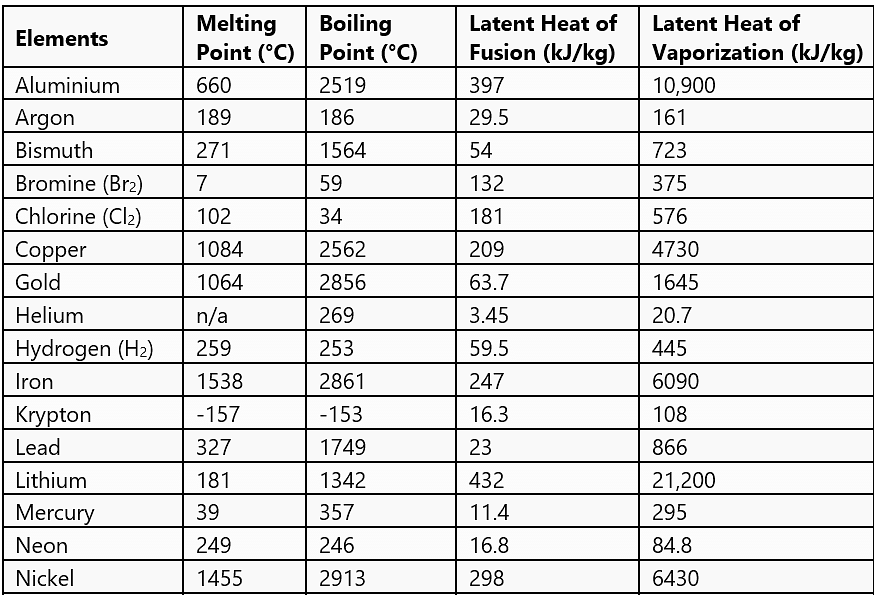
चुनिंदा सामग्रियों के लिए सामान्य अवस्था परिवर्तन मात्राएँ
- कालोरीमेट्री का अर्थ है ताप की माप। जब एक उच्च तापमान पर वस्तु को एक निम्न तापमान पर वस्तु के संपर्क में लाया जाता है, तो गर्म वस्तु द्वारा खोया गया ताप उस ठंडी वस्तु द्वारा प्राप्त ताप के बराबर होता है, बशर्ते कोई ताप वातावरण में नहीं निकलने दिया जाए। जिस उपकरण में ताप की माप की जा सकती है उसे कालोरीमीटर कहते हैं।
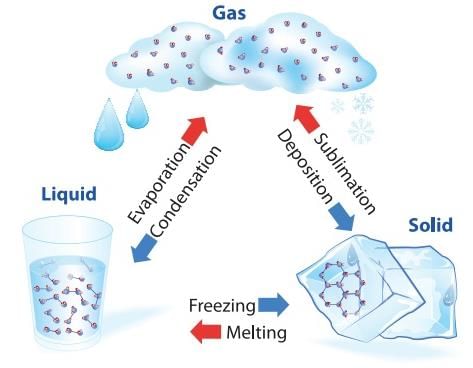
अवस्था में परिवर्तन
- पदार्थ सामान्यतः तीन अवस्थाओं में विद्यमान होता है: ठोस, तरल, और गैस। इन अवस्थाओं में से एक से दूसरी में संक्रमण को अवस्था परिवर्तन कहा जाता है। दो सामान्य अवस्थाएँ ठोस से तरल और तरल से गैस (और इसके विपरीत) हैं। ये परिवर्तन तब होते हैं जब पदार्थ और उसके वातावरण के बीच ताप का विनिमय होता है।
- पदार्थ का ठोस से तरल में परिवर्तन को पिघलना कहा जाता है और तरल से ठोस में परिवर्तन को संघनन कहा जाता है। यह देखा गया है कि तापमान तब तक स्थिर रहता है जब तक कि सभी ठोस पदार्थ पिघल न जाएँ। अर्थात्, ठोस और तरल दोनों अवस्थाएँ तापीय संतुलन में रहती हैं।
- जिस तापमान पर ठोस और तरल अवस्थाएँ तापीय संतुलन में होती हैं उसे पिघलने का बिंदु कहा जाता है। यह पदार्थ की विशेषता है और यह दबाव पर भी निर्भर करता है। मानक वायुमंडलीय दबाव पर पदार्थ का पिघलने का बिंदु सामान्य पिघलने का बिंदु कहलाता है।
- तरल से वाष्प (या गैस) में परिवर्तन को वाष्पीकरण कहा जाता है। यह देखा गया है कि तापमान तब तक स्थिर रहता है जब तक कि सभी तरल वाष्प में परिवर्तित न हो जाए। अर्थात्, तरल और वाष्प दोनों अवस्थाएँ तापीय संतुलन में रहती हैं।
- जिस तापमान पर तरल और वाष्प अवस्थाएँ सह-अस्तित्व में होती हैं उसे उबालने का बिंदु कहा जाता है। उच्च ऊँचाइयों पर, वायुमंडलीय दबाव कम होता है, जिससे जल का उबालने का बिंदु समुद्र स्तर की तुलना में कम हो जाता है। दूसरी ओर, प्रेशर कुकर के अंदर दबाव बढ़ाने से उबालने का बिंदु बढ़ता है, जिससे खाना जल्दी पकता है।
- सभी पदार्थ तीन अवस्थाओं: ठोस-तरल-गैस के माध्यम से नहीं गुजरते। कुछ पदार्थ सीधे ठोस से वाष्प अवस्था में और इसके विपरीत जाते हैं। ठोस अवस्था से वाष्प अवस्था में बिना तरल अवस्था में गुजरे को सब्लिमेशन कहा जाता है, और उस पदार्थ को सब्लाइम कहा जाता है। ड्राई आइस (ठोस CO2) और आयोडीन उदाहरण हैं।
- अवस्था परिवर्तन के दौरान पदार्थ और उसके वातावरण के बीच एक निश्चित मात्रा में ताप ऊर्जा का स्थानांतरण होता है। परिवर्तन के दौरान प्रति इकाई द्रव्यमान में स्थानांतरित होने वाली ताप की मात्रा को उस प्रक्रिया के लिए पदार्थ का लेटेंट हीट कहा जाता है।
- पिघलने के बिंदु पर ठोस को दी जाने वाली ताप ऊर्जा, जिससे वह तरल अवस्था में बिना किसी ताप वृद्धि के परिवर्तित होता है, उसे लेटेंट हीट ऑफ फ्यूजन कहा जाता है और तरल-गैस अवस्था परिवर्तन के लिए इसे लेटेंट हीट ऑफ वाष्पीकरण कहा जाता है।
- न्यूटन का ठंडा होने का नियम कहता है कि किसी वस्तु की ठंडा होने की दर उस वस्तु के वातावरण में अधिक तापमान के अनुपात में होती है।
|
1 videos|326 docs|212 tests
|















