NCERT सारांश: रसायन विज्ञान- 1 का सारांश | विज्ञान और प्रौद्योगिकी (Science & Technology) for UPSC CSE PDF Download
1. अम्ल
- शब्द 'अम्ल' लैटिन शब्द से लिया गया है, जिसका अर्थ है "खट्टा"। अधिकांश फलों और सब्जियों का खट्टा स्वाद उनके अंदर मौजूद विभिन्न प्रकार के अम्लों के कारण होता है। अधिकांश जानवरों और मनुष्यों के पाचन द्रव भी अम्लों को含含 करते हैं।
- अम्ल एक यौगिक है, जो पानी में घुलने पर केवल हाइड्रोनियम आयन (H3O+) उत्पन्न करता है। अम्ल की विशेषता इन हाइड्रोनियम आयनों की उपस्थिति के कारण होती है।
- अम्ल ऐसे यौगिक हैं जो हाइड्रोजन (हाइड्रोक्लोरिक, HCl; सल्फ्यूरिक, H2SO4; नाइट्रिक, HNO3) को含含 करते हैं। हालाँकि, सभी हाइड्रोजन含含 यौगिक अम्ल नहीं होते (जल, H2O; मीथेन, CH4)। अम्ल आमतौर पर हाइड्रोजन और कभी-कभी ऑक्सीजन के साथ गैर-धात्विक यौगिक होते हैं।
- अम्लों को विभिन्न तरीकों से वर्गीकृत किया जा सकता है, निम्नलिखित कारकों के आधार पर:
- (i) अम्ल की ताकत के आधार पर वर्गीकरण।
- (ii) अम्ल की बुनियादीता के आधार पर वर्गीकरण।
- (iii) अम्ल की सांद्रता के आधार पर वर्गीकरण।
- (iv) ऑक्सीजन की उपस्थिति के आधार पर वर्गीकरण।
- अम्ल की ताकत उस समाधान में मौजूद हाइड्रोनियम आयनों की सांद्रता पर निर्भर करती है। जितने अधिक हाइड्रोनियम आयन होंगे, अम्ल की ताकत उतनी ही अधिक होगी। हालाँकि, कुछ अम्ल जैसे कार्बोनिक अम्ल पानी में किसी भी appreciable स्तर पर विघटित नहीं होते। इसलिए, इन अम्लों में हाइड्रोनियम आयनों की सांद्रता कम होगी।
- मजबूत अम्ल: एक अम्ल, जो पानी में पूरी तरह से या लगभग पूरी तरह से विघटित होता है, उसे मजबूत अम्ल कहा जाता है। यह ध्यान रखना आवश्यक है कि इन अम्लों में सभी हाइड्रोजन आयन (H+) पानी के अणु के साथ मिलकर हाइड्रोनियम आयनों (H3O+) के रूप में मौजूद होते हैं। मजबूत अम्ल के उदाहरण हैं: हाइड्रोक्लोरिक अम्ल, सल्फ्यूरिक अम्ल, नाइट्रिक अम्ल आदि।
- कमजोर अम्ल: एक अम्ल जो पानी में घुलने पर केवल आंशिक रूप से विघटित होता है, उसे कमजोर अम्ल कहा जाता है। इस प्रकार के अम्ल में अधिकांश अणु अपने अणु रूप में ही समाधान में रहते हैं। उदाहरण: एसिटिक अम्ल, फॉर्मिक अम्ल, कार्बोनिक अम्ल आदि।
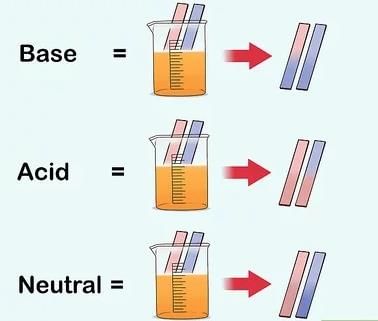
- मजबूत और कमजोर अम्लों की तुलना: अम्ल आमतौर पर खट्टे होते हैं। विशेष प्रकार की सामग्री का उपयोग यह परीक्षण करने के लिए किया जाता है कि कोई पदार्थ अम्लीय है या बुनियादी। इन पदार्थों को संकेतक कहा जाता है। संकेतक एक अम्लीय या बुनियादी पदार्थ वाले समाधान में जोड़े जाने पर अपना रंग बदलते हैं। हल्दी, लिटमस, चाइना गुलाब की पत्तियाँ (गुड़हल) आदि कुछ प्राकृतिक संकेतक हैं।
- सबसे सामान्य प्राकृतिक संकेतक लिटमस है। इसे लाइकेन से निकाला जाता है। यह आसुत जल में एक मौवे (बैंगनी) रंग का होता है। जब इसे अम्लीय समाधान में जोड़ा जाता है, तो यह लाल हो जाता है और जब इसे बुनियादी समाधान में जोड़ा जाता है, तो यह नीला हो जाता है। यह एक समाधान के रूप में या कागज के स्ट्रिप्स के रूप में उपलब्ध होता है, जिसे लिटमस पेपर कहा जाता है। आमतौर पर इसे लाल और नीले लिटमस पेपर के रूप में उपलब्ध किया जाता है।
- लिटमस पेपर का रंग परिवर्तन: वे समाधान जो लाल या नीले लिटमस का रंग नहीं बदलते हैं, उन्हें तटस्थ समाधान कहा जाता है। ये पदार्थ न तो अम्लीय होते हैं और न ही बुनियादी।
- अम्ल संक्षारक होते हैं और त्वचा को जला सकते हैं और धातु को घुला सकते हैं।
2. क्षार और क्षारीय पदार्थ
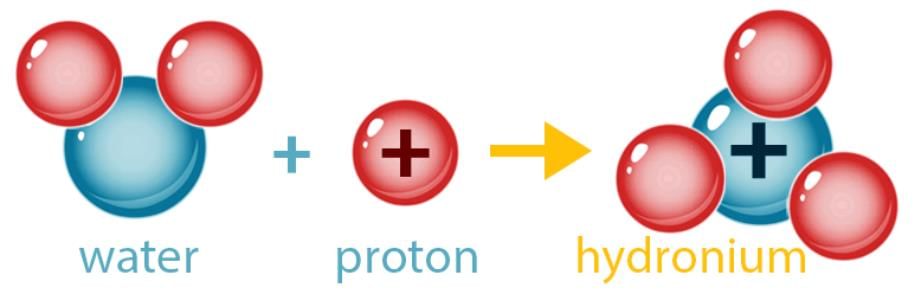

- एक आधार वह पदार्थ है जो पानी में घुलने पर OH आयन देता है। आधार आमतौर पर धातु हाइड्रॉक्साइड (MOH) होते हैं। उदाहरणों में सोडियम हाइड्रॉक्साइड (NaOH), कैल्शियम हाइड्रॉक्साइड (Ca(OH)2) शामिल हैं। पानी में आधार का समाधान अल्कली कहा जाता है।
- आधार और अम्ल एक-दूसरे को न्यूट्रलाइज करते हैं, इसलिए आधार को परिभाषित करने का एक और तरीका यह है कि यह एक यौगिक है जो अम्ल के साथ प्रतिक्रिया करके केवल नमक और पानी देता है।
- जैसे कि अम्ल, अल्कली भी मजबूत या कमजोर हो सकते हैं। जितने अधिक हाइड्रॉक्साइड आयन वे उत्पन्न करते हैं, उतना ही मजबूत अल्कली होता है।
- एक अम्ल की अम्लीयता हाइड्रोजन आयनों (H+) की उपस्थिति के कारण होती है, जबकि आधार या अल्कली की अम्लीयता हाइड्रॉक्सिल (OH–) आयनों की उपस्थिति के कारण होती है।
- जब एक अम्ल और आधार (अल्कली) मिलते हैं, तो अम्ल का सकारात्मक चार्ज वाला हाइड्रोजन आयन आधार के नकारात्मक चार्ज वाले हाइड्रॉक्सिल आयन के साथ मिलकर पानी के एक अणु का निर्माण करता है। इस प्रकार, बने हुए पानी के अणु का कोई चार्ज नहीं होता क्योंकि हाइड्रोजन और हाइड्रॉक्सिल आयनों के सकारात्मक और नकारात्मक चार्ज न्यूट्रल हो जाते हैं।
- एक आधार की ताकत उस समय हाइड्रॉक्सिल आयनों की संकेंद्रण पर निर्भर करती है जब इसे पानी में घुलाया जाता है।
1. मजबूत आधार: एक आधार जो पानी में पूरी तरह या लगभग पूरी तरह से विभाजित होता है उसे मजबूत आधार कहा जाता है। जितने अधिक हाइड्रॉक्सिल आयन आधार उत्पन्न करता है, उतना ही मजबूत आधार होता है। उदाहरण: सोडियम हाइड्रॉक्साइड (NaOH), पोटेशियम हाइड्रॉक्साइड (KOH), कैल्शियम हाइड्रॉक्साइड (Ca(OH)2)।
2. कमजोर आधार: एक आधार जो पानी में केवल आंशिक रूप से विभाजित होता है उसे कमजोर आधार कहा जाता है। उदाहरण: मैग्नीशियम हाइड्रॉक्साइड (Mg(OH)2), अमोनियम हाइड्रॉक्साइड (NH4OH)।
- आधार का स्वाद कड़वा होता है। ये स्पर्श में साबुन जैसे और फिसलन वाले होते हैं।
- मजबूत अल्कली जैसे सोडियम हाइड्रॉक्साइड और पोटेशियम हाइड्रॉक्साइड बेहद क्षरणकारी या कौस्टिक होते हैं।
- सोडियम हाइड्रॉक्साइड और पोटेशियम हाइड्रॉक्साइड को आमतौर पर कौस्टिक सोडा और कौस्टिक पोटाश कहा जाता है।
- इन दोनों अल्कलियों द्वारा जैविक ऊतकों जैसे त्वचा आदि का पूरी तरह से क्षरण हो जाता है। हालांकि, अन्य अल्कलियां केवल हल्के से क्षरणकारी होती हैं।
3. pH
- हाइड्रोजन आयन की सांद्रता मापने के लिए एक पैमाना विकसित किया गया है, जिसे pH स्केल कहा जाता है। pH में 'p' का अर्थ जर्मन शब्द ‘potenz’ से है, जिसका मतलब है शक्ति। pH स्केल पर हम pH को 0 (बहुत अम्लीय) से 14 (बहुत क्षारीय) तक माप सकते हैं। pH को सरलता से एक संख्या के रूप में सोचना चाहिए जो एक समाधान की अम्लीय या क्षारीय प्रकृति को दर्शाता है। हाइड्रोनियम आयन की सांद्रता जितनी अधिक होगी, pH मान उतना ही कम होगा। एक तटस्थ समाधान का pH 7 होता है।
- pH स्केल पर 7 से कम मान एक अम्लीय समाधान का प्रतिनिधित्व करते हैं। जैसे-जैसे pH मान 7 से 14 की ओर बढ़ता है, यह समाधान में OH– आयन की सांद्रता में वृद्धि को दर्शाता है, अर्थात्, क्षार की शक्ति में वृद्धि। सामान्यतः pH मापने के लिए यूनिवर्सल इंडिकेटर से impregnated कागज का उपयोग किया जाता है।
- ऐसे रासायनिक पदार्थ होते हैं जो विभिन्न pH मानों पर रंग बदलते हैं। इन्हें इंडिकेटर्स कहा जाता है। सबसे प्रसिद्ध में से एक लिटमस है। यह पदार्थ तब लाल हो जाता है जब pH 7 से कम होता है (अम्लीय) और जब pH 7 से अधिक होता है (क्षारीय) तो यह नीला हो जाता है।
4. नमक
- नमक तब बनता है जब एक अम्ल (acid) एक क्षार (base) के साथ अभिक्रिया करता है। दोनों तटस्थ (neutral) हो जाते हैं। H और OH- आयन पानी बनाने के लिए मिलते हैं। अम्ल के गैर-धात्विक आयन और क्षार के धात्विक आयन नमक बनाते हैं।
- महत्वपूर्ण नमक जो दैनिक जीवन और औद्योगिक उपयोग में उपयोग होते हैं वे हैं सोडियम क्लोराइड (NaCl), सोडियम कार्बोनेट (Na2CO3), सोडियम बाइकार्बोनेट (NaHCO3), सोडियम हाइड्रॉक्साइड (NaOH)।
- नमक के आयन सामान्यतः विलयन में रहते हैं। जब पानी निकाला जाता है तो नमक क्रिस्टलीकृत हो जाता है। कुछ नमक अविलेय (insoluble) होते हैं। वे अम्ल और क्षार को एक साथ मिलाने पर ठोस रूप में प्रकट होते हैं।
- एक मजबूत अम्ल और एक मजबूत क्षार के नमक तटस्थ होते हैं जिनका pH मान 7 होता है। दूसरी ओर, एक मजबूत अम्ल और कमजोर क्षार के नमक अम्लीय होते हैं जिनका pH मान 7 से कम होता है और एक मजबूत क्षार और कमजोर अम्ल के नमक मूलभूत होते हैं, जिनका pH मान 7 से अधिक होता है।
परमाणु संरचना
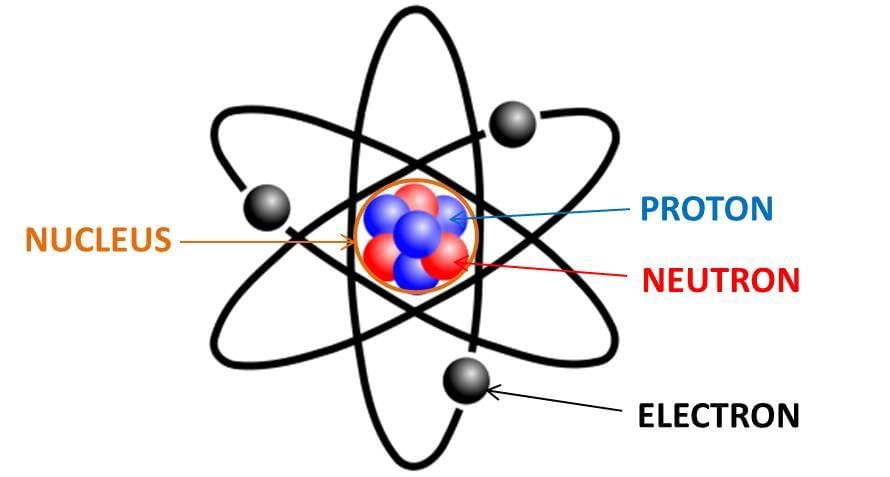
- एक परमाणु तत्व का सबसे छोटा कण है जो स्वतंत्र रूप से अस्तित्व में रह सकता है और अपने सभी रासायनिक गुणों को बनाए रख सकता है। परमाणु मूलभूत कणों से बने होते हैं: इलेक्ट्रॉन, प्रोटॉन, और न्यूट्रॉन।
➢ डाल्टन का परमाणु सिद्धांत
जॉन डाल्टन ने 1805 में रासायनिक संयोजनों के नियमों को सिद्ध करने के लिए एक सरल सिद्धांत प्रस्तुत किया।
सिद्धांत के मूलभूत प्रस्ताव हैं:
- सभी पदार्थ छोटे, अमूर्त कणों, जिन्हें परमाणु कहा जाता है, से बने होते हैं।
- एक ही तत्व के परमाणु आकार, आकार, द्रव्यमान और अन्य गुणों में समान होते हैं।
- प्रत्येक तत्व अपने स्वयं के प्रकार के परमाणुओं से बना होता है। विभिन्न तत्वों के परमाणु सभी दृष्टिकोण से भिन्न होते हैं।
- परमाणु रासायनिक संयोजनों में भाग लेने वाली सबसे छोटी इकाई है।
- परमाणु आपस में सरल पूर्णांक अनुपात में मिलकर यौगिक परमाणु बनाते हैं जिन्हें अणु कहा जाता है।
- परमाणु को किसी भी रासायनिक या भौतिक परिवर्तन के दौरान नहीं बनाया, विभाजित या नष्ट किया जा सकता है।
➢ एक परमाणु का प्रतीक द्वारा प्रतिनिधित्व
डाल्टन पहले वैज्ञानिक थे जिन्होंने तत्वों के लिए प्रतीकों का उपयोग बहुत विशिष्ट अर्थ में किया। जब उन्होंने किसी तत्व के लिए एक प्रतीक का उपयोग किया, तो इसका मतलब था कि वह तत्व की एक निश्चित मात्रा, अर्थात् उस तत्व का एक परमाणु। एक प्रतीक किसी तत्व के परमाणु का संक्षिप्त प्रतिनिधित्व करता है। किसी भी तत्व का प्रतीक अंग्रेजी नाम या लैटिन नाम (अंग्रेजी वर्णमाला में लिखित) पर आधारित होता है और कई प्रतीक तत्व के नाम के पहले या दूसरे अक्षर से बने होते हैं। प्रतीक के पहले अक्षर को हमेशा बड़े अक्षर (uppercase) में लिखा जाता है और दूसरे अक्षर को छोटे अक्षर (lowercase) में लिखा जाता है। उदाहरण: (i) हाइड्रोजन- H (ii) एल्युमिनियम- Al और नहीं AL (iii) कोबाल्ट- Co और नहीं CO। कुछ तत्वों के प्रतीक नाम के पहले अक्षर और नाम में बाद में आने वाले एक अक्षर से बने होते हैं। उदाहरण: (i) क्लोरीन - Cl (ii) जस्ता - Zn➢ परमाणु का आकार / तत्व
- परमाणु बहुत छोटे होते हैं, वे किसी भी चीज़ से छोटे होते हैं जिन्हें हम कल्पना कर सकते हैं या तुलना कर सकते हैं। एक हाइड्रोजन परमाणु, जो ज्ञात सबसे छोटा परमाणु है, का व्यास लगभग 5 x 10 मिमी है।
- परमाणु त्रिज्या नैनोमीटर में मापी जाती है। 1 मी = 109 नैनोमीटर।
➢ परमाणु द्रव्यमान
- एक विशेष परमाणु का द्रव्यमान एक मानक इकाई के रूप में लिया जाता है और अन्य परमाणुओं के द्रव्यमान को इस मानक से संबंधित किया जाता है। हाइड्रोजन सबसे हल्का तत्व है और इसे सबसे छोटे परमाणु के रूप में चुना गया है और इसका द्रव्यमान 1 माना गया है।
- हाइड्रोजन के एक परमाणु को एक परमाणु द्रव्यमान इकाई (A.M.U) के बराबर द्रव्यमान सौंपा गया। यह संख्या किसी परमाणु का द्रव्यमान ग्राम में नहीं दर्शाती है। यह केवल एक शुद्ध संख्या है।
- अन्य तत्वों के परमाणुओं के द्रव्यमान की तुलना हाइड्रोजन के द्रव्यमान से की गई, ताकि उनके द्रव्यमान को इसके सापेक्ष खोजा जा सके। यदि एक सल्फर का परमाणु हाइड्रोजन के 32 परमाणुओं के बराबर द्रव्यमान रखता है, तो सल्फर का सापेक्ष परमाणु द्रव्यमान 32 A.M.U है।
- एक हाइड्रोजन परमाणु के द्रव्यमान को परिभाषित करने का यह तरीका कठिनाइयों का सामना करता है। जबकि एक हाइड्रोजन परमाणु का द्रव्यमान 1 परमाणु द्रव्यमान इकाई माना जाता है, प्राकृतिक अवस्था में हाइड्रोजन गैस के 3 आइसोटोप होते हैं जिनका द्रव्यमान क्रमशः 1, 2 और 3 होता है। इस प्रकार औसत द्रव्यमान 1.00 A.M.U के रूप में काम करता है।
- इससे सभी अन्य तत्वों के परमाणु द्रव्यमान में जटिलता आती है। बाद में, ऑक्सीजन के एक परमाणु को मानक के रूप में चुना गया था जिसका द्रव्यमान 16 इकाइयाँ है।
- हालांकि, 1961 में एक सार्वभौमिक रूप से स्वीकार्य परमाणु द्रव्यमान इकाई के लिए, कार्बन-12 आइसोटोप को परमाणु द्रव्यमानों को मापने के लिए मानक संदर्भ के रूप में चुना गया।
एक परमाणु द्रव्यमान इकाई एक द्रव्यमान इकाई है जो एक कार्बन-12 के एक परमाणु के द्रव्यमान का ठीक एक बारहवाँ (1/12th) के बराबर है।
➢ अणु
एक अणु सामान्यतः दो या अधिक परमाणुओं का एक समूह है जो रासायनिक रूप से एक-दूसरे से जुड़े होते हैं, अर्थात् आकर्षक बलों द्वारा एक साथ मजबूती से बंधे होते हैं। एक अणु को एक तत्व या यौगिक का सबसे छोटा कण माना जा सकता है जो स्वतंत्र अस्तित्व में सक्षम है और उस पदार्थ के सभी गुणों को दिखाता है।
- एक ही तत्व के परमाणु या विभिन्न तत्वों के परमाणु एक साथ मिलकर अणु बना सकते हैं।
- एक तत्व के अणु समान प्रकार के परमाणुओं से बने होते हैं।
- कई तत्वों के अणु, जैसे कि आर्गन (Ar), हीलियम (He) आदि, केवल एक ही परमाणु से बने होते हैं।
- लेकिन अधिकांश गैर-धातुओं के साथ ऐसा नहीं होता है। उदाहरण: ऑक्सीजन का एक अणु दो ऑक्सीजन परमाणुओं से बना है और इसलिए इसे डायटॉमिक अणु, O2 के रूप में जाना जाता है।
- यदि 3 ऑक्सीजन परमाणु एक अणु में मिलते हैं, तो हमें ओजोन प्राप्त होता है।
- एक अणु में सम्मिलित परमाणुओं की संख्या को उसकी परमाण्विकता कहा जाता है।
- विभिन्न तत्वों के परमाणु निश्चित अनुपात में मिलकर यौगिकों के अणु बनाते हैं।
धातुओं और गैर-धातुओं से बने यौगिकों में चार्ज वाले प्रजातियाँ होती हैं। चार्ज वाले प्रजातियों को आयन कहा जाता है। एक आयन एक चार्जित कण होता है और यह नकारात्मक या सकारात्मक रूप से चार्जित हो सकता है। एक नकारात्मक चार्ज वाला आयन एनियन कहलाता है और सकारात्मक चार्ज वाला आयन कैशन कहलाता है। उदाहरण के लिए, सोडियम क्लोराइड (NaCl) इसके घटक कणों में सकारात्मक चार्ज वाले सोडियम आयन (Na+) और नकारात्मक चार्ज वाले क्लोराइड आयन (Cl-) शामिल होते हैं। आयन एकल चार्जित परमाणु या एक समूह के परमाणुओं का समूह हो सकते हैं जिन पर कुल चार्ज होता है। चार्ज ले जाने वाले परमाणुओं के समूह को पॉलीएटॉमिक आयन कहा जाता है।
➢ रासायनिक सूत्र
एक यौगिक का रासायनिक सूत्र इसकी संरचना का प्रतीकात्मक प्रतिनिधित्व है। विभिन्न यौगिकों के रासायनिक सूत्र को आसानी से लिखा जा सकता है। एक तत्व की संयोजन शक्ति (या क्षमता) को उसकी परमाणुविकता के रूप में जाना जाता है। परमाणुविकता का उपयोग यह पता लगाने के लिए किया जा सकता है कि एक तत्व के परमाणु दूसरे तत्व के परमाणु के साथ कैसे मिलकर रासायनिक यौगिक बनाएंगे।
- सरलतम यौगिक, जो दो विभिन्न तत्वों से बने होते हैं, उन्हें द्विआण्विक यौगिक कहा जाता है।
- जब हम यौगिकों के लिए रासायनिक सूत्र लिखते हैं, तो हम घटक तत्वों और उनकी परमाणुविकताओं को लिखते हैं।
- फिर हमें संयोजक परमाणुओं की परमाणुविकताओं को पार करना होता है।
- आयनिक यौगिकों के सूत्र बस संरचना में सकारात्मक और नकारात्मक आयनों के पूरे संख्या अनुपात होते हैं।
➢ आणविक द्रव्यमान
एक पदार्थ का आणविक द्रव्यमान उस पदार्थ के अणु में सभी परमाणुओं के परमाणु द्रव्यमानों का योग है। इसलिए, यह एक अणु का सापेक्ष द्रव्यमान है जो आणविक द्रव्यमान इकाइयों (u) में व्यक्त किया जाता है।
- एक पदार्थ की सूत्र इकाई द्रव्यमान उस यौगिक की सूत्र इकाई में सभी परमाणुओं के परमाणु द्रव्यमानों का योग है।
- सूत्र इकाई द्रव्यमान की गणना उसी प्रकार की जाती है जैसे हम आणविक द्रव्यमान की गणना करते हैं।
- एकमात्र अंतर यह है कि हम उस पदार्थ के लिए शब्द सूत्र इकाई का उपयोग करते हैं जिनके घटक कण आयन होते हैं।
वैज्ञानिक विभिन्न तत्वों के विभिन्न परमाणुओं के द्रव्यमानों की तुलना करने के लिए सापेक्ष परमाणु द्रव्यमान पैमाने का उपयोग करते हैं। कार्बन-12 समस्थानिक के परमाणुओं को 12 का सापेक्ष परमाणु द्रव्यमान सौंपा जाता है और सभी अन्य परमाणुओं का सापेक्ष द्रव्यमान कार्बन-12 परमाणु के द्रव्यमान की तुलना करके प्राप्त किया जाता है।
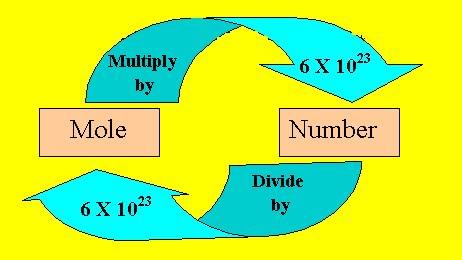
➢ मोल अवधारणा
चूंकि कणों का वजन व्यक्तिगत रूप से मापना संभव नहीं है, इसलिए सभी व्यावहारिक उद्देश्यों के लिए ऐसे कणों का एक समूह जिसे मोल कहा जाता है लिया जाता है। यह खोजा गया कि 12g कार्बन के 12C समस्थानिक में उपस्थित परमाणुओं की संख्या 6.023 × 1023 होती है। इसे एवोगाड्रो संख्या कहा जाता है।
- गैस का एक मोल उस पदार्थ की मात्रा होती है जिसमें 6.023 × 1023 कण होते हैं।
- यह पदार्थ की मात्रा या मात्रा की मूल इकाई है। यह पदार्थ परमाणु, अणु, आयन या आयनों के समूह हो सकते हैं।
- एक पदार्थ के 1 मोल का द्रव्यमान उसके मोलर द्रव्यमान के रूप में जाना जाता है।
- किसी भी गैस का एक मोल STP पर 22.4 L का आयतन होगा। इसे मोलर आयतन कहा जाता है।
- इलेक्ट्रॉन और प्रोटॉन की खोज का श्रेय क्रमशः J.J. Thomson और E. Goldstein को जाता है।
- J.J. Thomson ने प्रस्तावित किया कि इलेक्ट्रॉन एक सकारात्मक गोले में निहित होते हैं।
➢ रदरफोर्ड का परमाणु मॉडल
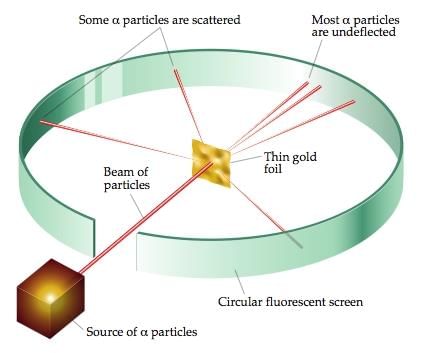
रदरफोर्ड का अल्फा-कण बिखराव प्रयोग परमाणु नाभिक की खोज की ओर ले गया। रदरफोर्ड के परमाणु मॉडल ने प्रस्तावित किया कि परमाणु के अंदर एक बहुत छोटा नाभिक उपस्थित है और इलेक्ट्रॉन इस नाभिक के चारों ओर घूमते हैं। इस मॉडल द्वारा परमाणु की स्थिरता को समझाया नहीं जा सका।
➢ नील्स बोहर का मॉडल
नील्स बोहर का परमाणु मॉडल अधिक सफल रहा। उन्होंने प्रस्तावित किया कि इलेक्ट्रॉन नाभिक के चारों ओर विभिन्न शेल में विवेचित ऊर्जा के साथ वितरित होते हैं। यदि परमाणु के शेल पूर्ण होते हैं, तो परमाणु स्थिर रहेगा और कम प्रतिक्रियाशील होगा।
➢ जे. चैडविक की खोज
जे. चैडविक ने परमाणु के नाभिक में न्यूट्रॉनों की उपस्थिति की खोज की। इसलिए, एक परमाणु के तीन उप-परमाणु कण हैं:
- (i) इलेक्ट्रॉन
- (ii) प्रोटॉन
- (iii) न्यूट्रॉन
इलेक्ट्रॉन नकारात्मक चार्जित होते हैं, प्रोटॉन सकारात्मक चार्जित होते हैं और न्यूट्रॉन में कोई चार्ज नहीं होता। इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन की खोज विज्ञान में नए अनुसंधान के द्वार खोलने का प्रारंभिक बिंदु था, जिसने भौतिकविदों को पदार्थ के परमाणुओं की संरचना और प्रकृति की समझ दी।
एक परमाणु तीन मूलभूत कणों से बना होता है, अर्थात् इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन। इलेक्ट्रॉन नकारात्मक चार्ज रखते हैं, प्रोटॉन सकारात्मक चार्ज रखते हैं और न्यूट्रॉन में कोई चार्ज नहीं होता। न्यूट्रॉन तटस्थ होते हैं। नकारात्मक इलेक्ट्रॉनों और सकारात्मक प्रोटॉनों की समान संख्या के कारण, समग्र रूप से परमाणु विद्युत रूप से तटस्थ होता है।
इन निष्कर्षों के आधार पर, कहा जा सकता है कि परमाणु की दो प्रमुख विभाजन हैं:
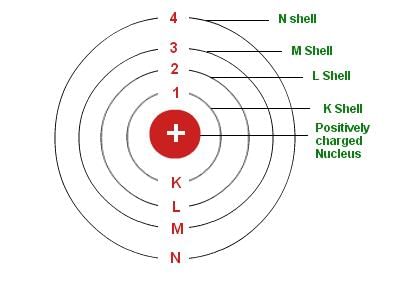
- (i) पहला, एक परमाणु का केंद्र, जिसे इसका नाभिक कहा जाता है। प्रोटॉन और न्यूट्रॉन परमाणु के केंद्र में छोटे नाभिक में स्थित होते हैं। प्रोटॉन की उपस्थिति के कारण नाभिक सकारात्मक चार्जित होता है।
- (ii) दूसरा इलेक्ट्रॉन होते हैं, जो विभिन्न शेल (या कक्षाओं) में नाभिक के चारों ओर घूमते हैं।
नाभिक के चारों ओर इलेक्ट्रॉन के घूमने के लिए जिस स्थान का निर्धारण होता है वह परमाणु के आकार को निर्धारित करता है।
एक शेल में अधिकतम उपस्थित इलेक्ट्रॉनों की संख्या सूत्र 2n2 द्वारा दी जाती है, जहाँ ‘n’ कक्ष संख्या या ऊर्जा स्तर सूचकांक है, 1, 2, 3,… आदि।
इस प्रकार, विभिन्न शेलों में अधिकतम उपस्थित इलेक्ट्रॉनों की संख्या निम्नलिखित है:
- (i) पहले कक्ष या K-शेल में = 2.12 = 2
- (ii) दूसरे कक्ष या L-शेल में = 2.22 = 8
- (iii) तीसरे कक्ष या M-शेल में = 2.32 = 18
- (iv) चौथे कक्ष या N-शेल में = 2.42 = 32, आदि।
बाहरीतम कक्ष में अधिकतम उपस्थित इलेक्ट्रॉनों की संख्या 8 होती है। इलेक्ट्रॉन को एक निर्दिष्ट शेल में तब तक नहीं रखा जाता जब तक आंतरिक शेल भरे नहीं जाते। अर्थात्, शेल को क्रमिक तरीके से भरा जाता है।
➢ परमाणुविकता
एक परमाणु के बाहरीतम शेल में उपस्थित इलेक्ट्रॉनों को परमाणुविक इलेक्ट्रॉन कहा जाता है। यह रासायनिक प्रतिक्रिया के दौरान निर्णायक शेल होता है। केवल इसी बाहरीतम शेल के इलेक्ट्रॉन रासायनिक संयोजनों में शामिल होते हैं, इलेक्ट्रॉन या तो बाहरीतम शेल से बाहर दिए जाते हैं, या बाहरीतम शेल में स्वीकार किए जाते हैं, या दूसरे तत्व के बाहरीतम शेल के इलेक्ट्रॉनों के साथ साझा किए जाते हैं।
- जिन तत्वों के परमाणुओं में समान संख्या में परमाणुविक इलेक्ट्रॉन होते हैं, उनके रासायनिक गुण समान होते हैं।
- एक परमाणु में परमाणुविक शेल की संख्या उस तत्व की स्थिति को आवर्त सारणी में निर्धारित करती है, अर्थात् उस तत्व का वह अवधि।
- जिन तत्वों के परमाणुविक शेल में 1, 2 या 3 इलेक्ट्रॉन होते हैं, वे धातुएँ होती हैं। अपवाद H और He हैं।
- जिन तत्वों के परमाणुविक शेल में 4 से 7 इलेक्ट्रॉन होते हैं, वे गैर-धातुएँ होती हैं।
परमाणुविकता एक तत्व की संयोजन क्षमता होती है। यह उन इलेक्ट्रॉनों की संख्या है जो एक परमाणु में वास्तव में बंधन निर्माण में भाग लेते हैं। उदाहरण के लिए, कार्बन परमाणु जिसका परमाणु संख्या 6 है, उसमें 4 परमाणुविक इलेक्ट्रॉन होते हैं।
परमाणुविकता की गणना: परमाणुविक इलेक्ट्रॉनों की संख्या तत्व की परमाणुविकता होती है। किसी तत्व की परमाणुविकता को ऑक्टेट पूरा करने के लिए आवश्यक इलेक्ट्रॉनों की संख्या ज्ञात करके भी गणना की जा सकती है। यदि किसी परमाणु का बाहरीतम शेल पूरी तरह भरा हो, तो उसकी परमाणुविकता = 0 होती है।
नैतिक गैसों जैसे हीलियम, नियोन, आर्गन, क्रिप्टन आदि के बाहरीतम शेल पूरी तरह भरे होते हैं। इसलिए उनकी परमाणुविकता शून्य होती है। ऐसे तत्व बहुत कम प्रतिक्रियाशील और प्रकृति से निष्क्रिय होते हैं।
➢ परमाणु संख्या
परमाणुओं का नाभिक प्रोटॉनों और न्यूट्रॉनों से बना होता है। नाभिक के इन दो घटकों को न्यूक्लियॉन कहा जाता है। इलेक्ट्रॉन नाभिक के बाहर के स्थान पर स्थित होते हैं।
चूंकि एक परमाणु विद्युत रूप से तटस्थ होता है, नाभिक में प्रोटॉनों की संख्या ठीक उसी संख्या के बराबर होती है जितनी इलेक्ट्रॉनों की होती है। यह संख्या परमाणु संख्या कहलाती है और इसे Z प्रतीक द्वारा दर्शाया जाता है।
➢ द्रव्यमान संख्या
एक तत्व के एक परमाणु में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या को उसकी द्रव्यमान संख्या कहा जाता है।
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
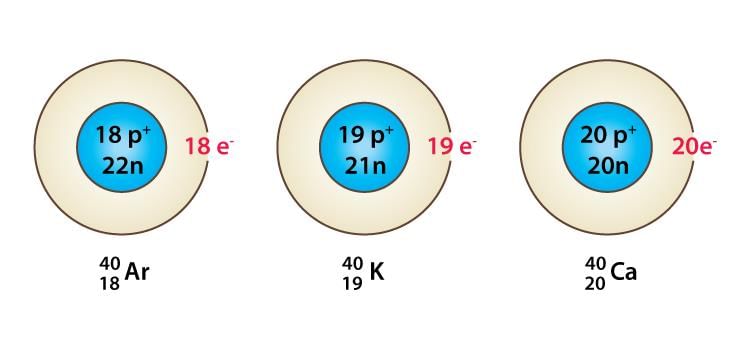
आइसोटोप: आइसोटोप एक ही तत्व के ऐसे परमाणु होते हैं, जिनकी द्रव्यमान संख्या अलग-अलग होती है।
- दिलचस्प बात यह है कि एक दिए गए परमाणु संख्या के परमाणुओं में न्यूट्रॉनों की संख्या भिन्न हो सकती है।
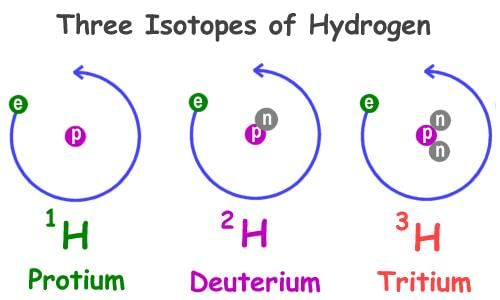
- उदाहरण के लिए, हाइड्रोजन परमाणु के मामले में, इसके तीन परमाणु प्रजातियाँ हैं, अर्थात् प्रोटियम (11H), ड्यूटेरियम (21H या D) और ट्रिटियम (31H या T)। प्रत्येक का परमाणु संख्या 1 है, लेकिन द्रव्यमान संख्या क्रमशः 1, 2 और 3 है।
- एक तत्व के सभी आइसोटोप में समान संख्या में परमाणुविक इलेक्ट्रॉन होते हैं, इसलिए उनके रासायनिक गुण समान होते हैं।
- आइसोटोप के भौतिक गुण न्यूट्रॉनों की संख्या में भिन्नता के कारण भिन्न होते हैं।
- घनत्व, पिघलने के बिंदु और उबालने के बिंदु आदि थोड़े भिन्न होते हैं।
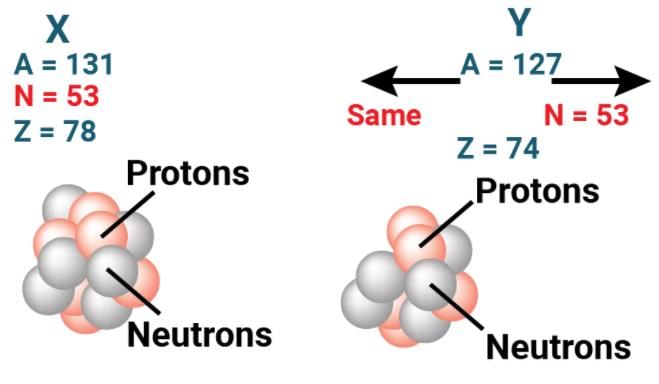
आइसोबार: विभिन्न परमाणु संख्याओं वाले विभिन्न तत्वों के परमाणु, जो समान द्रव्यमान संख्या रखते हैं, उन्हें आइसोबार कहा जाता है।
- इनमें प्रोटॉनों की संख्या भिन्न होती है लेकिन प्रोटॉनों और न्यूट्रॉनों की संख्या का योग समान होता है।
आइसोटोन: विभिन्न तत्वों के ऐसे परमाणु, जिनमें न्यूट्रॉनों की संख्या समान होती है लेकिन परमाणु संख्याएँ भिन्न होती हैं, उन्हें आइसोटोन कहा जाता है।
➢ रेडियोधर्मिता
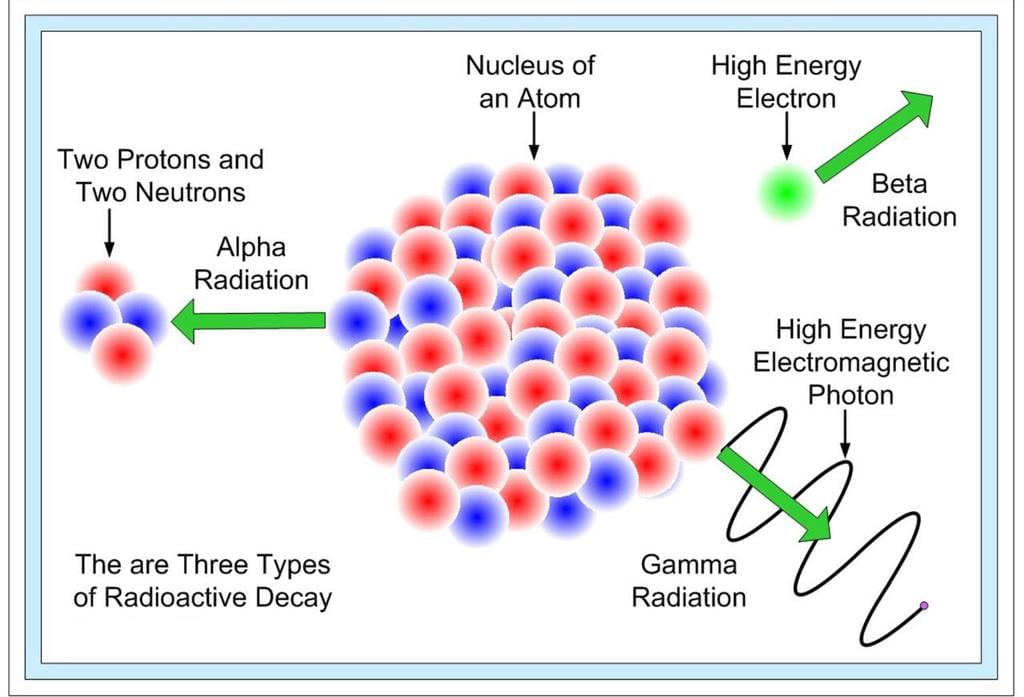
रेडियोधर्मिता एक नाभिकीय घटना है। यह नाभिक से विकिरण का स्वाभाविक उत्सर्जन है। 1899 में, अर्नेस्ट रदरफोर्ड ने रेडियोधर्मिता का अध्ययन शुरू किया। उन्होंने एक छोटे सीसे के बक्से के निचले हिस्से में थोड़ी मात्रा में रेडियम रखा और उससे निकलने वाली किरणों को उनके दिशा के विपरीत एक बहुत मजबूत चुंबकीय क्षेत्र के क्रिया में लाया।
उन्होंने पाया कि किरणें तीन अलग-अलग घटकों में विभाजित हो गईं। रदरफोर्ड ने तीन प्रकार के विकिरण को अल्फा (α), बीटा (β

आइसोटोप: आइसोटोप एक ही तत्व के परमाणु होते हैं, जिनके द्रव्यमान संख्या अलग होती है। यह ध्यान देने योग्य है कि एक दिए गए परमाणु संख्या के परमाणुओं में न्यूट्रॉनों की संख्या भिन्न हो सकती है। उदाहरण के लिए, हाइड्रोजन परमाणु के तीन परमाणु प्रजातियाँ हैं, अर्थात् प्रोटियम (11 H), ड्यूटेरियम (21 H या D) और ट्रिटियम (31 H या T)। प्रत्येक का परमाणु संख्या 1 है, लेकिन द्रव्यमान संख्या क्रमशः 1, 2 और 3 है।
- एक तत्व के सभी आइसोटोपों में समान संख्या में वैलेन्स इलेक्ट्रॉन होते हैं, इसलिए इनकी रासायनिक गुणधर्म समान होते हैं।
- आइसोटोप के भौतिक गुण न्यूट्रॉनों की संख्या में भिन्नता के कारण भिन्न होते हैं। घनत्व, पिघलने के बिंदु और उबलने के बिंदु आदि में थोड़ी भिन्नता होती है।
आइसोबार: विभिन्न तत्वों के परमाणु, जिनकी परमाणु संख्या भिन्न होती है, लेकिन द्रव्यमान संख्या समान होती है, उन्हें आइसोबार कहा जाता है। इनका प्रोटॉन की संख्या भिन्न होती है, लेकिन प्रोटॉन और न्यूट्रॉनों की संख्या का योग समान होता है।
आइसोटोन: विभिन्न तत्वों के परमाणु, जिनमें न्यूट्रॉनों की संख्या समान होती है लेकिन परमाणु संख्या भिन्न होती है, उन्हें आइसोटोन कहा जाता है।
रेडियोधर्मिता: रेडियोधर्मिता एक परमाणु घटना है। यह nucleus से विकिरण का स्वेच्छिक उत्सर्जन है। 1899 में, रेडियोधर्मिता का अध्ययन अर्नेस्ट रदरफोर्ड ने शुरू किया। उन्होंने एक छोटे सीसा के बक्से के नीचे थोड़ा रेडियम रखा और इसके निकलने वाले किरणों को उनके दिशा के प्रति 90 डिग्री पर एक बहुत मजबूत चुंबकीय क्षेत्र के प्रभाव में रखा। उन्होंने पाया कि किरणें तीन भिन्न घटकों में विभाजित हो गईं। रदरफोर्ड ने विकिरण के तीन प्रकारों को अल्फा (α), बीटा (β), और गामा (γ) किरणें कहा।
- अल्फा (α) किरणें बीटा (β) किरणों की विपरीत दिशा में विक्षिप्त होती हैं और अल्फा किरणों का चार्ज सकारात्मक होता है, जबकि बीटा किरणों का चार्ज नकारात्मक होता है। जो किरणें बिना विक्षेप के निकलती हैं, वे तटस्थ या निर्वात होती हैं, जिन्हें गामा (γ) किरणें कहा जाता है।
- रेडियोधर्मिता एक परमाणु घटना है। यह nucleus से विकिरण का स्वेच्छिक उत्सर्जन है।
- 1899 में, रेडियोधर्मिता का अध्ययन अर्नेस्ट रदरफोर्ड ने शुरू किया। उन्होंने एक छोटे सीसा के बक्से के नीचे थोड़ा रेडियम रखा और इसके निकलने वाले किरणों को उनके दिशा के प्रति 90 डिग्री पर एक बहुत मजबूत चुंबकीय क्षेत्र के प्रभाव में रखा।
- उन्होंने पाया कि किरणें तीन भिन्न घटकों में विभाजित हो गईं। रदरफोर्ड ने विकिरण के तीन प्रकारों को अल्फा (α), बीटा (β), और गामा (γ) किरणें कहा।
|
1 videos|326 docs|212 tests
|















