UPSC Exam > UPSC Notes > सामान्य विज्ञानं (General Science) for UPSC CSE in Hindi > रसायन विज्ञान (भाग - 1) - सामान्य विज्ञान
रसायन विज्ञान (भाग - 1) - सामान्य विज्ञान | सामान्य विज्ञानं (General Science) for UPSC CSE in Hindi PDF Download
| Table of contents |

|
| अणु एवं परमाणु |

|
| परमाणु संरचना |

|
| रेडियोधर्मिता (Radio activity) |

|
| धातु-कर्म (Metallurgy) |

|
| कार्बन के अपरूप |

|
अणु एवं परमाणु
 किसी तत्व का अणु वह सूक्ष्म कण है जो दो या दो से अधिक परमाणुओं के संयोग से बनता है। अणु स्वतंत्रा अवस्था में रहता है तथा इसमें द्रव्य के सभी गुण विद्यमान रहते है।
किसी तत्व का अणु वह सूक्ष्म कण है जो दो या दो से अधिक परमाणुओं के संयोग से बनता है। अणु स्वतंत्रा अवस्था में रहता है तथा इसमें द्रव्य के सभी गुण विद्यमान रहते है।
➤ मूलकण
- आरंभ में यह मान लिया गया था कि मूल कण तीन है- इलेक्ट्राॅन, प्रोटाॅन तथा न्यूट्राॅन। किन्तु कालान्तर में इन मूल कणों का भी विभाजन हुआ। अतः अब ये मूल कण नहीं रहे।
- स्थायी तथा कुछ अस्थायी कणो को मिलाकर कणों की संख्या तीस तक पहुँच चुकी है।
- इलेक्ट्रॉन, प्रोटॉन, प्रति-प्रोटॉन तथा पोजिट्रॉन- ये चार द्रव्यमान कण है।
- अस्थायी कणों में न्यूट्रॉन, मेसान तथा वी-कण मुख्य है।
➤ क्वार्क (Quark)
- पदार्थ के मूल कणो को बनाने वाले कणों को क्वार्क नाम दिया गया है। अभी तक क्वार्क एक काल्पनिक कण है। कुछ वैज्ञानिकों का मत है कि क्वार्क का अस्तित्व है और क्वार्कों के मिलने से दूसरे कण बनते है, क्वार्क कणों पर आंशिक आवेश होता है। इनके अस्तित्व के विषय में सर्वप्रथम अमरीका के भौतिकशास्त्रियों मुरेगेलमान और जार्ज ज्वीग ने 1964 में कल्पना की थी।
परमाणु संरचना
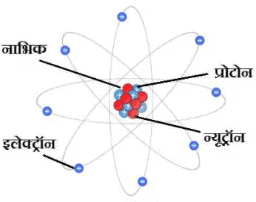
- परमाणु के केन्द्र में एक नाभिक (केन्द्रक) होता है जिसके चारों तरफ इलेक्ट्राॅन चक्कर लगाते है।
- इलेक्ट्राॅन ऋण आवेश युक्त कण है। इस पर सापेक्ष आवेश-1 और निरपेक्ष आवेश 1.6 x 10-19 कूलम्ब होता है।- इलेक्ट्राॅन का द्रव्यमान 1 हाइड्रोजन परमाणु के द्रव्यमान का 1/1840वां भाग होता है। इसका निरपेक्ष द्रव्यमान 9.1 x 10-28 होता है। नाभिक: इसमें दो कण है- प्रोटाॅन तथा न्यूट्राॅन।
- प्रोटॉन का आवेश इलेक्ट्रॉन के आवेश के बराबर और विपरीत चिन्ह वाला (अर्थात् + 1) होता है, और इसका द्रव्यमान 1 हाइड्रोजन परमाणु के द्रव्यमान के लगभग बराबर होता है।
- न्यूट्रॉन पर कोई आवेश नहीं होता, किंतु द्रव्यमान (1.00865) प्रोटॉन के बराबर होता है।
- परमाणु में उपस्थित प्रोटॉन की संख्या को परमाणु संख्या कहते है। चूंकि इसमें उपस्थिति इलेक्ट्राॅन की संख्या भी प्रोटाॅन की संख्या के बराबर होती है, अतः परमाणु संख्या इलेक्ट्राॅनों की संख्या को भी व्यक्त करती है।
- नाभिक में उपस्थित कणों (प्रोटॉन तथा न्यूट्रॉन) के योग का परमाणु-भार कहते हैं।
रेडियोधर्मिता (Radio activity)
- कुछ पदार्थ जैसे रेडियम, यूरेनियम, पोलोनियम, थोरियम आदि से रेडियोधर्मी विकिरण के निकलने की घटना ही रेडियोधर्मिता कहलाती है।
- इसका पता ‘बेकरेल’ ने लगाया था, किंतु ‘रेडियो एक्टिविटी’ का नाम इसे मैडम क्यूरी ने दिया।
- चुम्बकीय क्षेत्र के प्रभाव में यह किरण अल्फा (α), बीटा (β), तथा गामा (γ) किरणों में विभाजित हो जाती है।
- किसी पदार्थ का रेडियोधर्मी होना इसके न्यूट्रॉन/प्रोटॉन के अनुपात से निश्चित होता है। अगर यह अनुपात 1 से अधिक है तो तत्व रेडियोधर्मी होगा अन्यथा नहीं।
➤ उपचयन एवं अपचयन (Oxidation and Reduction)
- उपचयन (Oxidation)उपचयन वह अभिक्रिया है जिसमें
(i) ऑक्सीजन या अन्य अधातु (विद्युत ऋणात्मक तत्व) का योग हो, या
(ii) हाइड्रोजन या धातु (विद्युत धनात्मक तत्व) का निष्कासन हो, या
(iii) इलेक्ट्रॉन का ह्रास हो। - वे तत्व जो ऑक्सीकरण करें ऑक्सीकारक कहलाते है, जैसे-ऑक्सीजन (O2), ओजोन (O3), वायु, हाइड्रोजन पैराक्साइड (H2O2), हेलोजन (Cl, Br, I), नाइट्रिक अम्ल (HNO3), सल्फ्यूरिक अम्ल (H2SO4), पोटाशियम परमैंगनेट (KMnO4), पोटाशियम डाइक्रोमेट (K2Cr2O7) आदि।
➤ अपचयन (Reduction)
- अपचयन उस अभिक्रिया को कहते है जिसमें
(i) हाइड्रोजन या धातु का उपयोग या लाभ हो, या
(ii) ऑक्सीजन या अन्य अधातु तत्व का निष्कर्ष या हानि हो, या
(iii) इलेक्ट्रॉन का लाभ हो। - वह तत्व जो अवकरण करता है, अवकारक कहलाता है, जैसे-हाइड्रोजन, नवजात हाइड्रोजन, सल्फर डायआक्साइड (SO2), हाइड्रोजन सल्फाइड (H2S) धात्विक (-अस) लवण आदि।
- ऑक्सीकरण और अवकरण दोनों अभिक्रिया एक ही साथ होती है, अलग-अलग नहीं। एक तत्व इलेक्ट्राॅन का ह्रास करता है तो दूसरा उसका लाभ।
➤ pH पैमाना
- यह बताता है कि कोई घोल या तत्व अम्लीय, क्षारीय या उदासीन है।
- शुद्ध जल उदासीन होता है, और इसका pH, 7 होता है। अम्लीय घोल का pH, 7 से कम और क्षारीय घोल का pH, 7 से अधिक होता है।
- लवण-अम्ल और भस्म प्रतिक्रिया कर लवण बनाते है। यह उदासीन होता है।
➤ विद्युत विच्छेदन (Electrolysis)
- विद्युत धारा के प्रवाह द्वारा इलेक्ट्रोलाइट में विच्छेदन को विद्युत विच्छेदन कहते है।
➤ नॉन-इलेक्ट्रोलाइट
- वैसे पदार्थ का घोल जो विद्युत धारा का चालन नहीं करता, नन-इलेक्ट्रोलाइट कहलाता है।
(i) इलेक्ट्रोलाइट: वैसे पदार्थ का घोल जिसमें विद्युत धारा का चालन होता है।
(ii) इलेक्ट्रोड: धात्त्विक छड़ या प्लेट जिससे होकर विद्युत धारा का प्रवाह किया जाता है। - धनात्मक (+) इलेक्ट्रोड को धनोद (Anode) और ऋणात्मक इलेक्ट्रोड को ऋणोद कहते है।
➤ इलेक्ट्रोप्लेटिंग और गैल्वनाइजिंग
- इलेक्ट्रोप्लेटिंग प्रक्रिया द्वारा किसी धातु या मिश्र धातु पर लेप चढ़ाया जाता है।
- इस विधि में जिस धातु पर लेप चढ़ाना हो उसका ऋणोद तथा जिसका लेप चढ़ाना हो उसका धनोद इलेक्ट्रोलाइट लिया जाता है।
- विद्युत धारा प्रवाहित करने पर धनोद घुल-घुलकर ऋणोद पर जमता जाता है। अच्छे परिणाम के लिए निम्न ताप और उच्च विद्युत धारा का प्रयोग किया जाता है।
- गैल्वनाइजिंग प्रक्रिया में धातु के पिघले हुए सस्ते में डुबोकर बाहर निकाल लिया जाता है। लेपित धातु पर वायुमंडलीय कारक का कोई प्रभाव नहीं पड़ता।
➤ दर्पण का रजतन तथा रजत प्लेटिंग
- दर्पण के रजतन में मरक्यूरिक ऑक्साइड तथा मरकरी के घोल का लेप चढ़ा दिया जाता है, ताकि प्रतिबिम्ब देखा जा सके।
- रजत प्लेटिंग में विद्युत-विच्छेदन विधि द्वारा किसी धातु पर लेप चढ़ाया जाता है।
धातु-कर्म (Metallurgy)

विज्ञान की वह शाखा जिसमें धातु का उसके अयस्कों से निष्कर्षण तथा धातु-मिश्र (Alloys) के बनाने की विधि का अध्ययन करते है, धातु कर्म कहलाता है।
- खनिज (Minerals): धातु के अनेक प्रकार के यौगिक जो प्रकृति में मिलते है।
- अयस्क (Ores): वे खनिज जिनसे धातु का निष्कर्षण सुगमतापूर्वक हो सके।
- गैंग (Gangue) अयस्क के अनुपयोगी अयस्क।
- सांद्रण (Concentration) चूर्णित अयस्क से गैंग को दूर करने की विधि।
- कैल्सीनेशन: द्रवनांक से नीचे अयस्क को गर्म करना।
- स्मेल्टिंग (Smelting): यह नाम विभिन्न प्रकार की विधियों को दिया गया है जिसके द्वारा फ्लक्स की उपस्थिति में अवकरण द्वारा धातु का उसके आॅक्साइड से निष्कर्षण किया जाता है।
स्मरणीय तथ्य
- कास्टिक सोडा या कास्टिक पोटाश को जस्ता, एल्युमिनियम या टिन के साथ गर्म किए जाने पर हाइड्रोजन बनता है।
- लाल तप्त कोक पर वाष्प प्रवाहित करने पर हाइड्रोजन और कार्बन मोनोक्साइड का मिश्रण बनता है। इस मिश्रण को जल गैस कहा जाता है।
- कार्बन डाइऑक्साइड गैस को चूना जल से प्रवाहित करने पर कैल्सियम कार्बोनेट का दुधिया अवक्षेप बनता है, जिससे चूना-जल का रंग दुधिया हो जाता है। किन्तु अधिक गैस प्रवाहित किये जाने पर कैल्सियम बाइ-कार्बोनेट बनता है, जिससे घोल पुनः स्वच्छ बन जाता है।
- कार्बन डाइऑक्साइड में मैग्नीशियम का जलता हुआ फीता ले जाने पर काले-काले कण प्राप्त होते है। काले कण कार्बन डाइऑक्साइड से मुक्त कार्बन होते है।
- श्वेत या पीला फास्फोरस को खास-खास अक्रिय गैस की उपस्थिति में कास्टिक सोडा के साथ गर्म करने पर फाॅस्फीन निकलती है और सोडियम हाइपो फाॅस्फेट बनता है।
- श्वेत फास्फोरस हवा में मुक्त छोड़ने पर 30°ब् ताप पर अपने आप जल उठता है और ऑक्सीजन से संयोग कर फाॅस्फोरस पेंटाक्साइड का उजला धुँआ उत्पन्न करता है।
- सल्फर डाई आक्साइड गैस में जलता हुआ मैग्नीशियम का फीता गंधक मुक्त करता है और मैग्निशियम आक्साइड बनता है।
- लकड़ी, ऊन, चीनी आदि को समाहृत सल्फ्यूरिक अम्ल के साथ मिलाने पर ये झुलस जाते है, क्योंकि यह इनके जल को अवशोषित कर लेता है और कार्बन शेष बच जाता है।
- गर्म शुष्क बुझा हुआ चूना (Slaked lime) से क्लोरीन गैस प्रवाहित करने पर विरंजक चूर्ण का निर्माण होता है।
- तूतिया को गर्म करने पर इसका रवाजल निकल जाता है और यह नीला से रंगहीन हो जाता है।
- कार्बनिक पदार्थों का विघटन जीवाणु के कारण होता है।
- एक लीटर ठंडे जल का वजन एक लीटर शुष्क वायु से अधिक होता है, क्योंकि निम्न तापमान पर अणु संख्या बढ़ जाती है।
- समुद्र जल का घनत्व, जैसे-जैसे इसकी गहराई और इसमें लवण की मात्रा बढ़ती है, बढ़ता जाता है।
- गोबर गैस में प्रमुखतः मिथेन गैस रहती है।
- प्रकृति में कार्बन रवादार तथा बेरवादार दोनों रूपों में मिलता है।
कार्बन के अपरूप
➤ हीरा (Diamond)
- कार्बन का सबसे शुद्ध रूप है।
- संसार के कुछ प्रसिद्ध हीरे है-
(i) होप 44.5 कैरेट,
(ii) कोहिनूर 186 कैरेट,
(iii) कुल्लिनन (Cullinan) 300.2 कैरेट,
(iv) पिट (Pitt) 136.6 कैरेट। - कृत्रिम हीरा मोइना (Moissan) विधि से तैयार किया जाता है।
- शुद्ध हीरा रंगहीन, रवादार तथा पारदर्शी होता है।
- अशुद्धियों के कारण यह रंगीन भी होता है।
- यह सबसे कड़ी वस्तु है। 800°C पर गर्म करने से इससे CO2 गैस निकलती है।
- वायु की अनुपस्थिति में हीरा को 2000°C तक गर्म करने पर वह ग्रेफाइट में बदल जाता है। यह विद्युत तथा उष्मा का कुचालक है।
➤ ग्रेफाइट

- यह विद्युत तथा ऊष्मा का सुचालक है।
उपयोग: पेन्सिल बनाने में, बिजली भट्ठी के लिए विद्युत द्वार बनाने में, भारी मशीनों में, स्नेहक के रूप में।
➤ कोयला
- यह निम्न प्रकार का होता है।
(i) पीट (Peat): कार्बन 70%
(ii) लिग्नाइट (Lignite): कार्बन 67%। यह आसानी से जलता है मगर ताप कम उत्पन्न होता है।
(iii) कैनल कोयला (Cannel Coal): यह जलने पर अधिक धुंआ देता है, अतः इसे कोल गैस बनाने के काम में लाया जाता है।
(iv) बिटुमिनस कोयला: कार्बन 80%। रेल इंजन में इंधन के रूप में उपयोगी।
(v) एन्थ्रासाइट: कार्बन 70%। बेहद कड़ा होता है। - जल गैस- CO + H2 (कार्बन मोनोऑक्साइड + हाइड्रोजन)
- कोल गैस- H2, CH4, C2H4, C2H6 (हाइड्रोजन, मीथेन, एथिलीन और एसिटिलिन)
- क्लोरीन गैस उपचयन (Oxidation) विधि द्वारा किसी रंगीन वस्तु का विरंजन करता है; यह विरंजन स्थायी होता है।
- सल्फर डाई आक्साइड (SO2) द्वारा विरंजन अपचयन (Reduction) द्वारा होता है और यह अस्थायी होता है। यह कोमल वस्तु जैसे रेशम, ऊन आदि के विरंजन के लिए उपयोग में लाया जाता है।
- रेल की पटरियाँ मैगनीज इस्पात की बनी होती हैं। मैगनीज इस्पात में 9% - 15% तक मैगनीज़ होता है।
- स्टेनलेस स्टील में मैंगनीज की मात्रा 8.25% तक रहती है।
- हरा कसीस (Green vitriol) FeSO4 .7H2O। उपयोग- दवा बनाने में, स्याही बनाने में, कपड़ा रंगने में।
The document रसायन विज्ञान (भाग - 1) - सामान्य विज्ञान | सामान्य विज्ञानं (General Science) for UPSC CSE in Hindi is a part of the UPSC Course सामान्य विज्ञानं (General Science) for UPSC CSE in Hindi.
All you need of UPSC at this link: UPSC
|
74 videos|226 docs|11 tests
|
FAQs on रसायन विज्ञान (भाग - 1) - सामान्य विज्ञान - सामान्य विज्ञानं (General Science) for UPSC CSE in Hindi
| 1. अणु और परमाणु में क्या अंतर है? |  |
उत्तर: अणु और परमाणु दोनों ही अणु के आणविक भाग हैं, लेकिन वे अलग-अलग अर्थों में उपयोग होते हैं। अणु एक आणविक भाग है जिसमें प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉन मौजूद होते हैं। परमाणु एक अणु का पर्यायार्थी शब्द है और इसका मतलब होता है कि अणु का अत्यंत छोटा भाग है। इसलिए, अणु और परमाणु दोनों ही संरचनात्मक रूप से वस्तु के अत्यंत छोटे भाग होते हैं।
| 2. परमाणु संरचना क्या होती है? |  |
उत्तर: परमाणु संरचना एक अणु के आणविक तत्वों के व्यवस्थित विवरण को दर्शाती है। इसमें प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉन का संख्यात्मक और आणु संरचना में स्थानांतरण का विवरण होता है। यह आणविक तत्वों के बीच संघटनात्मक बंधों को भी दर्शाती है जो उन्हें सबसे सटीक रूप से संरचित करते हैं।
| 3. रेडियोधर्मिता क्या होती है? |  |
उत्तर: रेडियोधर्मिता विज्ञान का एक शाखा है जो धातुओं और अन्य पदार्थों के अस्थायी और स्थायी बदलाव को अध्ययन करती है जो निकटतम कारण से धातु और पदार्थों के अस्थायी बनाते हैं। यह अध्ययन उनकी अवधियों, तापमान, दबाव, और अन्य उपयोगी दिशाओं पर विचार करता है। रेडियोधर्मिता विज्ञान में रेडियोधर्मी धातुओं का उपयोग नियंत्रण, उत्पादन और अनुप्रयोगों में किया जाता है।
| 4. धातु-कर्म क्या है? |  |
उत्तर: धातु-कर्म धातुओं के उत्पादन, शोध, परीक्षण, और उनके उपयोग के विभिन्न पहलुओं का अध्ययन करता है। यह विज्ञानी तकनीक है जो धातुओं के विभिन्न गुणों, रचनात्मक और भौतिक गुणों, उत्पादन प्रक्रियाओं और उनके उपयोग के विभिन्न पहलुओं का अध्ययन करती है। धातु-कर्म अनुशासनिक और व्यावसायिक उपयोग के लिए धातु विज्ञान का उपयोग करता है।
| 5. कार्बन के अपरूपरसायन विज्ञान क्या है? |  |
उत्तर: कार्बन के अपरूपरसायन विज्ञान एक विज्ञान है जो कार्बन और उसके यौगिकों के अभ्यास के लिए प्रयोग किया जाता है। यह शाखा विज्ञान कणीका है जो कार्बन के यौगिकों के गुणधर्म, संरचना, और उनके रासायनिक प्रभाव का अध्ययन करती है। कार्बन के अपरूपरसायन विज्ञान में कार्बन की यौगिक पदार्थों का उपयोग विभिन्न कार्यों में किया जाता है जैसे कि उत्पादन, उपयोग, और विभिन्न रासायनिक प्रक्रियाओं में।
|
74 videos|226 docs|11 tests
|
Download as PDF

|
Explore Courses for UPSC exam
|

|
Signup for Free!
Signup to see your scores go up within 7 days! Learn & Practice with 1000+ FREE Notes, Videos & Tests.
Related Searches


















